取一只纸杯,在底部开一小孔,倒置在实验桌上(倒置时纸杯下垫木条使纸杯的下边缘一端稍稍抬起),用纸团堵住小孔,先收集满氢气后,拿掉堵小孔的纸团。用燃着的长木条在小孔处点燃氢气,实验过程如图所示:
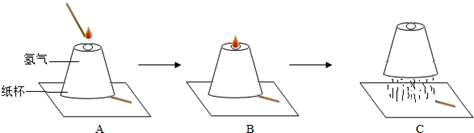
(1)请写出B中氢气燃烧的实验现象 。
(2)用理化知识解释C中纸杯被高高掀起的原因 。
请结合图回答问题:

(1)仪器名称:① ,② 。
(2)用高锰酸钾制取氧气,可选用的发生装置是 (选填序号),该反应的化学方程式为 。用E装置收集氧气完毕后,应先 (选填"从水中取出导气管"或"熄灭酒精灯")。
(3)实验室制取CO 2,反应的化学方程式为 ,为方便控制反应的发生和停止,应选择的发生装置是 (选填序号),可用D装置收集CO 2的理由是 。
(4)NH 4Cl溶液与NaNO 2溶液混合共热可制取氮气,氮气和氢气在一定条件下可生成氨气。如图是实验室制氮气并模拟合成氨的装置。

①合成氨时参加反应的氮气和氢气的质量比为 。
②实验中烧杯内导管口有气泡,还可观察到 现象。
某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe 2O 3)。用该废渣制取CaCl 2晶体(CaCl 2•xH 2O)并进行组成测定,其制取的流程如图1所示:

已知:NH 4Cl溶液显酸性,且浓度越高酸性越强
(1)XRD图谱可用于判断某固态物质是否存在。图2为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式 。

(2)浸取时需连续搅拌,其目的是 ;生成的NH 3能使湿润的红色石蕊试纸变 色。
(3)在其它条件相同的情况下,CaCl 2的产率随浸取温度的变化如图3所示。则宜选择的浸取温度为 ℃左右。
(4)若使用过量浓度较高的NH 4Cl溶液,则所得CaCl 2溶液中会含有NH 4Cl、 (填化学式)等杂质。
(5)过滤得到的Fe 2O 3在高温下可与CO反应,写出该反应的化学方程式 。
(6)测定晶体(CaCl 2•xH 2O)的组成:
a.称取14.7000g CaCl 2晶体于锥形瓶内,加入适量蒸馏水。使其全部溶解。
b.再向其中加入足量的Na 2CO 3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。 。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加 ,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值 (填"偏大"、"偏小"或"不变")。
氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe 2O 4)可用于循环分解水制氢,其反应可表示为:
6ZnFe 2O 4  6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O
6ZnO+4Fe 3O 4+O 2↑;3ZnO+2Fe 3O 4+H 2O  3ZnFe 2O 4+H 2↑
3ZnFe 2O 4+H 2↑
(1)ZnFe 2O 4中Fe的化合价为 。
(2)该循环制氢中不断消耗的物质是 (填化学式),得到H 2和O 2的质量比为 。
(3)氢气作为新能源的优点有 (任写一点)。该循环法制氢的不足之处是 。
Ⅱ.贮氢:合金Mg 2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg 2Cu+3H 2  3MgH 2+MgCu 2
3MgH 2+MgCu 2
(4)熔炼制备Mg 2Cu合金时,通入氩气的目的是 。
(5)氢化物MgH 2与水反应生成一种碱,并释放出H 2. 其化学反应方程式为 。
(6)11.2g Mg 2Cu完全吸氢后所得混合物与过量盐酸反应,放出H 2的质量为 g。
图中A~M是初中化学常见的物质,且分别由H、C、O、Na、S、Cl、K、Fe中一种或几种元素组成。B、C、E、F、M均由两种元素组成,B中两种元素质量之化为7:3.固态E叫做"干冰";A、D、H均由三种元素组成,H在实验室可用于制取氧气;G是焙制糕点所用的发酵粉的主要成分之一。图中"﹣"表示两端的物质间能发生化学反应;"→"表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(l)写出化学式:G ,B 。
(2)写小H→I反应的化学方程式 。
(3)写出A与D反应的化学方程式 。
实验课上,同学们利用下列装置进行气体制备的学习。请回答下列问题:

(1)编号①的仪器名称是 。
(2)用加热法制取氧气,所选择的发生装置是 (填字母,下同),收集装置是 ,反应的化学方程式为 。
(3)若要制取瓶纯净、干燥的二氧化碳气体 (常混有少量氯化氢气体和水蒸气,装置连接的正确顺序是:产生气体→ → →F.检验二氧化碳气体的方法是 。