某同学利用以下药品:长、宽和厚度均相同的锌片、铁片和铜片,稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序。
(1)实验前,用砂纸打磨金属片的目的是: ;
(2)根据实验目的,该同学设计了实验Ⅰ、Ⅱ两中合理的方案,如图I所示:

若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现为青色。
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色。
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,以检验其组成为铁和铜。粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图Ⅱ所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 。
在学习复分解反应发生的条件后,同学们利用已学知识,对稀盐酸与下表中的四种化合物的溶液之间能否发生反应作出判断。并进行实验验证:
|
物质 |
氢氧化钠溶液 |
硫酸钠溶液 |
碳酸钾溶液 |
硝酸银溶液 |
|
实验现象 |
无明显现象 |
无明显现象 |
产生气泡 |
产生白色沉淀 |
|
能否反应 |
能反应 |
不能反应 |
能反应 |
能反应 |
【提出问题】对于上述无明显现象的反应,如何设计实验进行验证?
【设计实验】为了验证氢氧化钠溶液与稀盐酸能发生化学反应,小刚设计了如下实验方案并进行实验。
|
实验步骤 |
实验现象 |
实验结论 |
|
①将氢氧化钠溶液滴入盛有稀盐酸试管中,振荡 |
溶液呈无色 |
稀盐酸与氢氧化钠溶液能发生化学反应 |
|
②向步骤①所得无色溶液中滴加几滴酚酞溶液 |
溶液呈无色 |
【分析讨论】小刚设计的实验方案 (填“可行”或“不可行”),说明理由: 。
【总结提升】通过以上实验分析,对于无明显现象的反应,验证思路可以是:
(Ⅰ)验证生成物是否存在。
(Ⅱ)验证 是否消失。
【拓展迁移】(1)氢氧化钠溶液与稀盐酸发生反应的微观示意图如图所示,该反应的实质是 。写出另一个符合上述反应实质的化学方程式 。
(2)将一定量的氢氧化钠溶液与稀盐酸混合,充分反应后所得溶液中溶质成分可能有
种情况,具体的溶质组合情况分别是 (填化学式)。

如图是实验室常用气体制备装置,据图回答问题:

(1)图中标号①仪器名称是 。用A装置制取氧气的化学方程式是 。选择C装置收集氧气是因为 。集满氧气的集气瓶应 (填“正”或“倒”)放在桌面上。
(2)用装置F和装置 (填序号)收集并测量O2体积,实验时气体应从装满水的装置F中的导管 (填“a”或“b”)端通入。
(3)实验室常用加热氯化铵和熟石灰固体混合物制取极易溶于水的氨气(NH3)。若要制取并收集干燥的氨气,正确的装置连接顺序是 (填字母代号)。
牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。

(1)反应①的化学方程式为 ;操作1的名称是 。
(2)反应②的化学方程式为 ,该反应属于 反应(填基本反应类型)。
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由 。
(4)大气中CO2含量不断上升,会导致 。我国在联台国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施 。
随着世界人口的增长,人类对农产品需求量增大,增施化肥逐渐成为农作物增产的最有力措施。NH4HCO3、NH4Cl、K2SO4、KCl都是常见的化肥。
(1)化肥能为农作物补充的营养元素主要有三种,上述化肥含有的两种营养元素是 。
(2)有一包用剩的肥料,可能含有上述四种化肥中的一种或几种,为确定其成分,进行了如下实验:
a.取少量肥料样品于研钵中,加入少量熟石灰混合研磨,有刺激性气味。
b.取少量肥料样品于烧杯中,加水溶解,得到无色溶液A。
c.取少量溶液A于试管中,滴加AgNO3溶液,有白色沉淀产生。
d.取少量溶液A于试管中,滴加BaCl2溶液,无明显现象。
e.取少量溶液A于试管中,滴加稀盐酸,无明显现象。
①分析上述实验过程,关于该肥料的成分可以得到的结论是 。
②实验a~e中,不必要进行的一项是 (填标号)。
③设计实验方案进一步确定该肥料的成分,完成下表。(已知:NH4Cl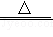 NH3↑+HCl↑)
NH3↑+HCl↑)
|
实验操作 |
预期现象与结论 |
|
|
若 ,则该肥料的成分是 。 若 ,则该肥料的成分是 。 |
镉(Cd)及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为+2。
(1)将含镉物质进行分类,各举一例填入图中(写化学式)。

(2)根据金属化学性质的一般规律,下列预测合理的是 (填标号)。
A.镉能与氢氧化钠溶液反应
B.H2或CO能将镉的氧化物转化为金属镉
C.镉能与盐酸或稀硫酸反应
D.硫酸镉溶液中的硫酸锌可加入镉粉除去
(3)已知硫酸镉易溶于水,设计三种制备硫酸镉的方案(要求含镉原料分别属于不同的物质类别)。完成下表:
|
方案 |
预期反应的化学方程式 |
依据的反应规律 |
|
① |
|
金属活动性顺序里,前面的金属能把后面的金属从它化合物的溶液里置换出来 |
|
② |
|
(略) |
|
③ |
|
(略) |