实验室常用石灰石和稀盐酸制取二氧化碳。
探究一 气体发生装置的选择
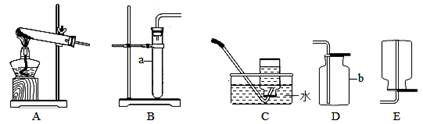
(1)写出图中带标号仪器的名称:a ;b 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),检验集满的方法是 。
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
| 组别 |
药 品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
粉末状石灰石和稀盐酸 |
产生气泡速率很快 |
对照实验①③,是探究 对产生二氧化碳速率的影响;
对照实验 ,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为 。
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量

途径一(如图1):由图可知产生二氧化碳的质量为 g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。
酸碱理论的发展如图:

(1)根据朴素的酸碱理论,Na2CO3属于 (选填“酸”或“碱”)。
(2)根据酸碱电离理论理解酸碱反应的实质是: 。
(3)已知H2CO3→HCO3﹣+H+和HCO3﹣→CO32﹣+H+,由酸碱质子理论,H2CO3的共轭碱是 。
(4)随着认知水平的不断提高,人们对酸碱理论的描述也在不断完善。下列对不同酸碱理论的分析合理的是 。
A.酸碱电离理论认为酸碱是两种不同的物质
B.酸碱电离理论认为氧元素是酸中必不可少的元素
C.酸碱质子理论认为酸和碱可以是分子,也可以是离子
D.酸碱质子理论扩大了酸和碱的范围,不再具有局限性
实验室有一瓶敞口放置的氢氧化钠固体样品,为探究样品中的成分,小科进行如下实验:

(1)操作①是加水充分溶解,操作②的名称是 。
(2)沉淀B的化学式是 。
(3)小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由 。
"加氢几分钟,畅行数百里",这是2021上海车展上为氢能源汽车打出的标语。氢能源汽车使用的是氢燃料电池(如图所示)。电池工作时在催化剂的作用下,氢原子失去电子形成氢离子,穿过电极A通过电解液移动到电极B与氧离子结合形成水分子;而电子则从电极A经外部电路通过电动机  到达电极B,形成电流。
到达电极B,形成电流。
(1)氢燃料电池工作时是将化学能直接转化为 能。
(2)氢气是氢燃料电池的原料,可以在用电低谷时,利用电网多余电能电解水来制取。已知1.2kg氢气大约可供某款氢能源汽车行驶100km,请根据化学方程式计算,制取1.2kg氢气至少需要电解多少质量的水。
(3)氢燃料电池工作时,通过电动机的电流方向是: 。
(4)世界能源组织提出:在制氢过程中基本上没有碳排放而得倒的氢气称为绿氢。下列方式可制得绿氢的是 。
| A. |
水力发电制氢 |
| B. |
太阳能发电制氢 |
| C. |
火力发电制氢 |
| D. |
核能发电制氢 |

为测定石灰石样品中碳酸钙含量,某小组同学在一定质量的样品中加入足量稀盐酸,利用生成CO2的质量来测定(忽略稀盐酸挥发的影响)。

(1)小科用图甲装置实验,通过测定反应前后D装置质量的变化来得到CO2质量。为了避免水蒸气对实验的影响,使测最结果更准确,装置C中应装入 (填试剂名称)。
(2)小明用图乙装置实验,通过测定反应前后装置总质量的变化来得到CO2质量。他用碱石灰做干燥剂,请判断这种做法是否合理并说明理由 。
(3)实验时。正确选择干燥剂后,两装置均可通过左侧导管鼓入某种气体一段时间,来进一步减小误差。下列操作可行的是 。
|
选项 |
实验装置 |
反应开始前鼓入的气体 |
反应结束后鼓入的气体 |
|
A |
甲 |
氮气 |
氮气 |
|
B |
甲 |
干燥空气 |
干燥空气 |
|
C |
乙 |
氮气 |
氮气 |
|
D |
乙 |
干燥空气 |
干燥空气 |
20世纪30年代,美国科学家鲁宾和卡门利用18O分别标记H2O和CO2,将C18O2和CO2分别通入含小球藻的H2O和H218O中(如图所示),迅速收集产生的氧气。
(1)18O和16O互为 原子,H218O和H2O以及CO2和C18O2具有相同的化学性质,因此可以用来示踪物质变化情况。
(2)该实验是为了研究 。
(3)该实验必须在 条件下进行。
(4)制备含有较多小球藻的液体时,需在盛有小球藻的液体中加入 (选填“无机盐”或“无机盐和有机物”),并置于适宜环境下培养。
