如图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂)制取干燥的氧气,并用来侧定,10g某铜粉样品(含杂质碳)中铜的质量分数.回答下列问题:

(1)仪器a的名称是 .
(2)装置A中发生反应的化学方程式是 .装置B的作用是 .
(3)通过称量反应前后装置 的质量,进行计算便可求出样品中铜的质量分数.
(4)实验完毕.小丽同学误将用剩的H202溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发现有大最的气泡产生,经检验确认产生的气体是氧气.小刚和小明两位同学对此颇感兴趣.进而展开了他们的探究之旅.
【提出问题】是哪种物质加快了H202的分解速率?
【大胆猜想】猜想Ⅰ:剩余固体中的氧化铜加快了H202溶液的分解.
猜想Ⅱ:剩余固体中的 加快了H2O2溶液的分解.
猜想Ⅲ:氧化铜能做H202分解的催化剂.
【实验验证】
| 实验方案 |
实验现象 |
分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL 5%H2O2溶液的试管. |
带火星木条不复燃 |
H202溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H202溶液的试管中加入1g氧化铜固体,将一根带火星的木条伸入试管.观察现象.待反应结束后将试管里的剩余物进行 、洗涤、干燥、称量.对比反应前后氧化铜的质量 |
称得固体质量为1g. |
猜想Ⅰ成立.反应前后氧化铜的质量相等. |
| 实验三:向盛有5mL5%H202溶液的试管中加入1g ,将一根带火星的木条伸入试管,观察现象. |
没有气泡产生,带火星 木条不复燃. |
猜想Ⅱ (填”成立“或“不成立”) |
【讨论交流】小刚同学认为,根据实验二得出的两个结论就能判断Ⅲ成立,你是否支持他的观点?并简述理由。
答: 。 .
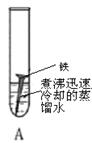
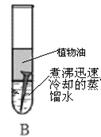
生活中铁制品容易锈蚀,某课外学习小组探究铁生锈的条件,用洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙,实验装置图如下。
| 实验操作 |
 |
 |
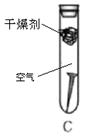 |
一周后观察到只有A中的铁钉生锈,而B、C中铁钉均无变化,请回答下列问题:
(1)在B试管中蒸馏水需要煮沸并覆盖一层植物油的目的是 。
(2)实验 和实验 对比,证明了铁钉生锈需要接触氧气。
(3)某同学将A试管中生锈的铁钉浸入装有足量的稀盐酸的试管中,发现溶液颜色由无色逐渐变成 ,这是因为 (用化学方程式表示);一段时间后,该同学发现试管中有气泡产生,这气体是 。
某兴趣小组的同学为探究金属的化学性质、以及锈蚀的条件进行了以下系列实验,仔细分析后回答下列问题:
(1)实验一:小明按下图1所示以“金属表面产生气泡的快慢”为标准来判断锌、铝、铁的活动性强弱,有同学认为不够合理,理由是_____________。铝与稀盐酸刚接触时反应缓慢,一段时间后剧烈,产生气泡速率随着加快,其原因可能是____________。三种金属活动性由强到弱顺序为_______________。(写元素符号)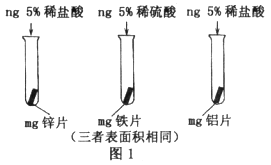
(2)实验二:为探究铁、铜、银三种金属活动性的顺序,小红提出按上图2进行两步实验,即可证明三种金属活动性顺序。你认为其方案可行吗?_________________。(填“可行”或“不可行”)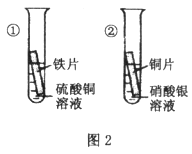
a.试管①中现象是__________________________________;
b.试管②中发生反应的化学方程式为__________________________________。
(3)实验三:小芳、小亮两位同学发现铜质眼镜架上出现了一些绿色的锈渍。经查阅资料得知,铜锈的化学成分是碱式碳酸铜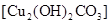 。他们依照钢铁生锈的探究方法设计如下实验(下图3所示):①将光亮铜片部分浸入蒸馏水中;②将光亮铜片完全浸入煮沸过的蒸馏水中;③将光亮铜片放在干燥的空气中。请回答:
。他们依照钢铁生锈的探究方法设计如下实验(下图3所示):①将光亮铜片部分浸入蒸馏水中;②将光亮铜片完全浸入煮沸过的蒸馏水中;③将光亮铜片放在干燥的空气中。请回答:
a.推测一段时间后会出现铜锈的是_________________试管内的铜片。(填“①”、“②”或“③”)
b.根据上述实验,小亮同学认为:铜的锈蚀是铜与水、氧气共同作用的结果。你是否同意他的观点?_________________。(填写“是”或“否”)
c.小芳同学认为要弄清导致铜锈蚀的因素,还应该再补充如下图4所示的实验。此实验目的是_________________,写出铜生锈的化学方程式_________________。
某兴趣小组对“蜡烛燃烧的产物”进行探究。
【查阅资料】蜡烛的主要成分是石蜡,石蜡由碳、氢两种元素组成。
【作出猜想】蜡烛燃烧的产物是二氧化碳和水。
【实验验证】(1)用干冷的小烧杯罩在蜡烛火焰上,观察到 ,证明有水生成。
(2)用涂有饱和石灰水的小烧杯罩在蜡烛火焰上,石灰水变浑浊,证明有二氧化碳生成。二氧化碳和石灰水反应的化学方程式为 。小明提出质疑:石灰水变浑浊不一定是生成碳酸钙,还可能是饱和石灰水受热后 ,析出了氢氧化钙。同学们又用下图所示的装置进行实验,1分钟后,提起锥形瓶,翻转后注入20mL饱和石灰水,加塞、振荡,观察到石灰水变浑浊,确定有二氧化碳生成。
实验中小明观察到一个意外现象:锥形瓶内壁上有少量黑色物质。
【交流讨论】经分析,同学们一致认为黑色物质是石蜡不充分燃烧生成的 。由此他们猜想还可能生成一氧化碳。
为验证一氧化碳,他们设计了如图所示的实验。
【实验验证】(1)实验前,先在玻璃管的中部放入一团棉花,其目的是 。
(2)将a端插入蜡烛的焰心。
(3)用酒精灯加热b端的糊状物,一段时间后,观察到黑色物质变成红色,证明蜡烛不充分燃烧有一氧化碳生成。
(4)为防止玻璃管中的红色物质又被氧化变成黑色,接下来的操作是: 。
【拓展应用】含碳燃料不充分燃烧会生成一氧化碳等物质,浪费资源,且污染空气。为使其充分燃烧,应采取的措施是 (答一条即可)。
学校化学探究小组用HCl与大理石反应研究影响反应剧烈程度的因素。实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10 g;所用HCl溶液的质量分数为9.125%、18.25%,每次实验HCl溶液的用量为20mL(假设两种溶液密度均为1 g/㎝3;大理石中杂质不与盐酸反应)。
【提出问题】:影响HCl与大理石反应的剧烈程度的因素有哪些?
【做出猜想】:
猜想一:大理石规格;猜想二:所用HCl溶液的质量分数;猜想三: 。
【实验探究】:完成以下实验设计方案并实验。
| 实验 编号 |
T/℃ |
大理石 规格 |
HCl的 质量分数 |
完全反应 的时间/s |
实验目的 |
| ① |
25 |
粗颗粒 |
18.25% |
160 |
(I)实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响。 (II)实验①和③探究温度对该反应剧烈程度的影响。 (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响。 |
| ② |
210 |
||||
| ③ |
35 |
粗颗粒 |
18.25% |
60 |
|
| ④ |
100 |
【得出结论】: 。
(2013福建漳州)根据实验装置图回答问题
(1)写出标号仪器名称:① ;② 。
(2)写出A装置试管中发生反应的化学方程式 。
(3)若要制取氧气并测定体积,需将上述A、B、C装置进行组装,则导管口的连接顺序为
a→ → →b;能用C装置收集氧气,是因为氧气 。
(4)将产生的氧气分别通入D、E装置中,观察到D中的白磷 ,E中的白磷 ;这一事实说明可燃物燃烧必备的条件是 。