【2014年四川省南充市】今年我市的化学实验操作考试有“制取并收集一瓶二氧化碳”的考题.
(1)指出标号①的仪器名称;
(2)实验室制取二氧化碳选用的发生装置和收集装置为 (填序号),反应的化学方程式为 .
(3)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究.
【提出问题】:废液中的溶质含有哪些物质
【猜想与假设】:猜想Ⅰ:溶液中的溶质只有CaCl2;
猜想Ⅱ:废液中的溶质有 .
【进行实验】:兴趣小组的同学取废液进行了以下实验,请你与他们一起完成下列实验报告.
| 实验操作 |
实验现象 |
实验结论 |
| 取少量反应后的废液于试管中,向其中加入Na2CO3溶液至过量 |
只有 |
猜想Ⅰ正确 |
| 先 后 |
猜想Ⅱ正确 |
如果猜想Ⅰ正确,有关反应的化学方程式为: ;
【反思拓展】:如果猜想Ⅱ正确,要是废液中只含有CaCl2,正确的处理方法是加入过量的 .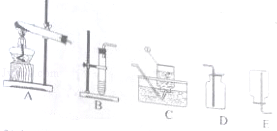
同学们利用“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
【实验探究】
(1)A、B、C、D四组同学分别进行了下列实验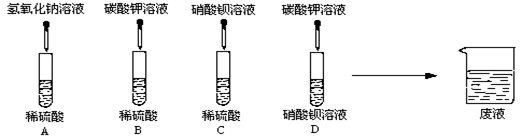
写出下列的两个化学方程式:
①A中的反应 。
②D中的反应 。
【挖掘实质】
下图是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O
【实践运用】
完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,用无色溶液滴加紫色石蕊试剂,变为红色。
(1)①溶液中的白色沉淀一定是 ,理由是 。
(2)废液中一定不含有的离子是 。
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
| 溶液中可能含有的离子 |
实验步骤 |
实验现象 |
实验结论 |
| 可能含有 |
②取滤液滴加 |
现象明显 |
含有该离子 |
某化学兴趣小组学习酸、碱、盐性质后,通过实验对碱的化学性质进行验证和总结,如图所示(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl).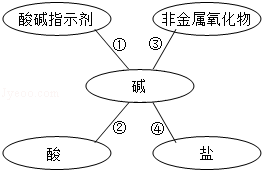
(1)甲同学将酚酞试液滴入Ca(OH)2溶液中,观察到溶液变红,得出结论:Ca(OH)2溶液呈 (填“酸性”、“碱性”或“中性”);
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到红色褪去,此时所得溶液中含有的溶质
有 (酸碱指示剂除外);
(3)丙同学根据反应③得出结论:实验室存放碱溶液时需 ;
(4)丁同学将Na2CO3溶液加入Ca(OH)2溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是 (酸碱指示剂除外),可能含有的溶质是 ;为验证可能含有的溶质,应该补充的实验操作是 .
下图物质为初中化学常见物质,请根据叙述回答问题:(“→”表示转化关系,“—”表示反应关系)。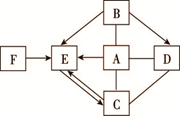
(1)甲为银白色金属,能与溶液A反应得到浅绿色溶液,则甲的化学式为 。
(2)乙为厨房内常用的调味品,可由A、B两种溶液发生中和反应得到,则A与B反应的化学方程式为 。
(3)固体C常用于改良酸性土壤,且C与D反应可得到B,则C与D反应的化学方程式为 。
(4)E、F的物质类别相同,且E与F能反应放热,F也能与A溶液发生反应,则F与A反应的化学方程式为 。
(5)若将盛有饱和C溶液的小烧杯放入一只大烧杯中,并在大烧杯中加入下列物质,观察到小烧杯中饱和C溶液变浑浊,则加入的物质组合可能是 (填序号)。
①氢氧化钠固体和水
②镁和稀盐酸
③硝酸铵固体和水
④氯化钠固体和水
⑤碳酸氢钠和稀盐酸
小亮在做家庭小实验时,欲探究从资料上获知的:家用发酵粉(主要成分是NaHCO3)在焙制糕点时,受热分解成Na2CO3、CO2和水而使糕点酥松多孔的原理。请你结合他的探究过程回答下列问题:
(1)小亮设计了如右图所示的A、B两套实验装置,装置中均为干燥的烧杯,还准备了一瓶澄清石灰水。
①你认为装置 (填序号)比较合理,在实验中烧杯内壁上可看到的现象是 ;
②证明生成了CO2的实验的化学方程式为 ;
(2)干粉灭火剂的主要成分是 (选填Na2CO3或NaHCO3)。
(3)如果Na2CO3中混有少量的NaHCO3,欲除去其中的NaHCO3,应采取的方法是 。
粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质CaCl2,MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题:
(1)实验操作A的名称是 ,该操作的目的是 .
(2)写出步骤③中发生反应的主要化学方程式 ;步骤⑥的作用是 .
(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由: .