如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.
该钙片主要成分碳酸钙,碳酸钙的相对分子质量为 ① .
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为 .
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.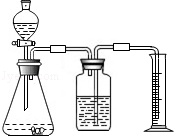
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会 ① (填偏大或偏小),你认为他们的理由是 ② ,你的改进方案是 ③ ;广口瓶内原有的空气对实验结果 ④ (填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是 .
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.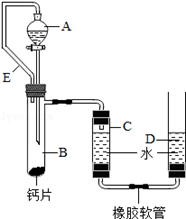
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是: ;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是 (填“真实”或“不真实”)的.(最后一空不需要写计算过程)
细心的同学发现在加热硫酸铜晶体时,会闻到刺激性气味,这引起了同学们的兴趣。难道生成的硫酸铜粉末受热后还能分解?那分解的产物是什么呢?
通过查阅资料,同学们了解到:
1、硫酸铜受热分解生成氧化铜和气体。气体是由SO2、SO3、O2中的一种或几种。受热时
温度不同,生成的气体成分也不同。
2、SO2、SO3都能被碱石灰吸收。
3、SO2、SO3都能被氢氧化钠溶液吸收。
【提出猜想】根据质量守恒定律猜测气体的成分:
I. 只含 ▲一种; II.含有SO2、O2二种; III.含有SO2、SO3、O2三种。
【设计实验】利用下图装置加热硫酸铜粉末直至完全分解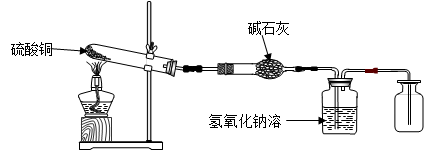
A B C D
【获取事实】
(1)用带火星的木条伸入集气瓶D,发现木条能复燃,说明气体中含有 ▲。
(2)已知硫酸铜粉末质量为10.0克,完全分解后,各装置的质量变化关系如下表所示:
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0克 |
75.0克 |
140.0克 |
| 反应后 |
37.0克 |
79.5克 |
140.0克 |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是哪一个 ? ▲
A.3CuSO4△3CuO+SO3↑+2SO2↑+O2↑ B. 4CuSO4△4CuO+2SO3↑+2SO2↑+O2↑
C.5CuSO4△5CuO+SO3↑+4SO2↑+2O2 ↑ D. 6CuSO4△6CuO+4SO3↑+2SO2↑+O2↑
某学校科学兴趣小组想设计一个实验,来模拟研究CO2:浓度增加是否增大地球“温室效应”。他们查阅了有关数据:
并设计了下面的实验和操作步骤:
Ⅰ、在两只同样的玻璃瓶里分别充满CO2和空气,并编号为甲、乙,塞紧带有同样温度计的橡皮塞。再把两只玻璃瓶放在阳光下照射(如右图),观察甲、乙瓶中的温度变化。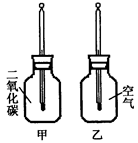
Ⅱ、.阳光持续照射,间隔一定时间测量两玻璃瓶温度值,并记录(见下表)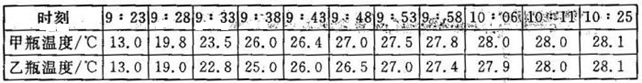
请回答下列问题:
(1)、写出实验室制取CO2的化学方程式。
(2)、往瓶中充CO2时,验证瓶中已充满了CO2的方法是。
(3)、该实验中,照射同样时间,根据上表的数据,比较甲、乙瓶温度变化的规律是
。
(4)、该实验中,在阳光照射下,影响甲、乙瓶温度不同的原因,除了CO2的温室效应以外,还有的可能原因是(写出一点即可)
有同学认为根据该模拟实验的目的,实验设计存在问题,你认为是(写出一点即可)
。
下图甲是氢气和氧化铜反应的实验,下图乙是木炭和氧化铁反应的实验。
(1)、在上述两个实验中,氢气和木炭表现出相同的化学性质是性。
(2)、实验步骤的先后次序非常重要,比如甲实验中,反应前必须先通氢气后点燃酒精灯,否则易发生爆炸;反应结束后必须先后,否则生成的红色的铜会变成黑色。
(3)、某同学正确操作做完乙实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中 也未产生预期的气泡,这说明该反应并没有生成
(4)、该同学查阅资料,得到关于铁的氧化物如下信息: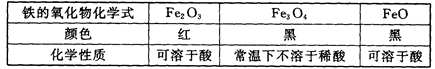
根据以上信息,试写出乙实验试管中反应的化学方程式
经分析后,该同学试着提高反应温度后,实验出现了预期的现象。
为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”。其工艺流程大致是:
I、从高处喷淋下的海水(pH=8.1-8.3)洗脱从下而上燃煤烟气中的SO2, (SO2+H2O=H2SO3H2SO3是弱酸),海水变为弱酸性;
Ⅱ、.将洗过烟气后的海水与氧气充分接触,发生下列反应:
4NaC1+O2十2H2SO3 ==2Na2SO4+4HC1
III.再将与氧气充分接触的海水跟大量天然海水混合等措施,使各项指标接近天然海水后再排放。
(1)、在坐标图中画出“海水法烟气脱硫工艺”全过程中海水的pH依次变化大致趋势。
(2)、工艺流程中天然海水接触烟气后变为弱酸性,这说明在此过程中海水中的离子和H2SO3电离出的氢离子发生了反应。
(3)、若要测定海水中Na2SO4含量,实验操作步骤是:
取少量被测海水,测定、加入足量的溶液(写化学式)、再加入稀硝酸、过滤、洗涤、烘干、称量沉淀质量。
某同学看到装有薯片的包装袋总是鼓鼓的,里面充有气体,他进行了如下探究:
(1)他提出的问题是。
(2)其他同学一致认为该实验方案是不合理的,正确的实验方案是:将收集的气体,观察现象。