某化学兴趣小组对课本介绍的三种金属Mg、Fe、Cu的金属活动性进行探究。
【提出假设】a:Fe金属活动性比Mg强,
b:Mg金属活动性比Fe强
【查阅资料】在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
【实验设计】同温下,取质量相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。
【回答问题】(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是
| A.除去氧化膜,利于直接反应 | B.使表面不平整,易反应 |
| C.使表面光亮,易观察现象 | D.使反应金属温度相同,易反应 |
(2)填写下表中的有关现象和结论:
| |
Fe |
Mg |
Cu |
| 与盐酸反应现象 |
放出气泡速度缓慢 |
放出气泡速度快 |
_________________ |
| 结 论 |
原假设中_______不正确(填“a”、“b”、“ab”),理由___ ____;三种金属的金属活动性顺序为____>_____>______。 |
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40 mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60 mL且润滑性很好的针筒注射器组成如图的实验装置。假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题: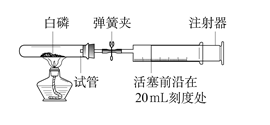
(1)实验前,打开弹簧夹,将注射器活塞前沿从20 mL刻度处推至15 mL刻度处,然后松开手,若活塞仍能返回至20 mL刻度处,则说明;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象为___________________________________________;
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:_________________________________________________。
用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法。实验过程是: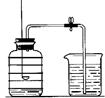
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。请回答下列问题:
(1)上面的实验同时证明了氮气有的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是。
(3)第二步中发生反应的文字表达式为________________________________。
(4)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是:。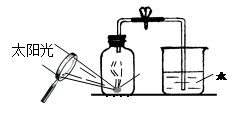

请你帮助小林同学完成“探究碱式碳酸铜(铜绿)的性质”实验的报告:
[实验目的]探究铜绿的性质
[实验用品]略
[实验过程及现象记录]
(1)观察铜绿的颜色和状态等物理性质:铜绿是绿色粉末状固体。
(2)用药匙或纸槽分别取少量铜绿于两支试管中
(3)然后用胶头滴管向其中一支试管中逐滴滴加稀盐酸,观察到铜绿逐渐溶解,产生大量_____,并形成蓝色溶液
(4)将另一支试管在酒精灯上加热,一段时间后,观察到固体粉末逐渐变成____色,且试管壁有水雾出现,若把产生的气体通入澄清石灰水中,石灰水会变浑浊。
[实验结论]铜绿具有的化学性质是:
(1)铜绿能与_____________反应;
(2)铜绿受热易分解,由分解的产物可推断出铜绿是铜在空气中与______、_______、_______等发生复杂的化学变化生成的。
为了研究质量守恒定律,设计了右图“白磷燃烧前后质量测定”的实验,请分析有关问题: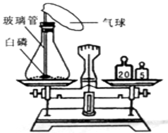
(1)装置:锥形瓶的底部铺有一层细沙,其作用是.
(2)燃烧前称量,锥形瓶的总质量为27.6g,则右图托盘天平中游码的读数为 g.
(3)白磷燃烧:白磷燃烧过程中看到的现象是 .
(4)燃烧后称量:发现托盘天平指针偏向右边,造成的原因可能是
(5)反思:白磷燃烧 (填“遵守”或“不遵守”)质量守恒定律,理由是 .
铁矿石冶炼成铁是一个复杂的过程,把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为。某化学兴趣小组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为。
为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【查阅资料】氢氧化钠溶液和澄清石灰水化学性质类似,能与二氧化碳反应,但反应无明显现象。
【进行实验】实验步骤及注意事项如下:
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入下图装置A的试管中;另一份放入下图装置B的玻璃管中。
②装置A和B两组实验同时开始进行。在装置B的反应中,实验开始前应先(选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是。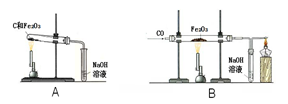
【实验现象】当装置B的玻璃管中固体完全由时(选填“红色变为黑色”或“黑色变为红色”),装置A的试管中仍有。
【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【交流与反思】经过查阅资料和讨论,该小组同学发现除了上述原因外,工业上不用焦炭作为还原剂直接还原铁矿石还有一些其它原因,试写出其中的一个:。
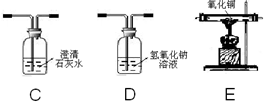
【完善实验】联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过下图的检验装置,正确的连接顺序是(选填字母,装置可重复使用)。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2,因此装置A的不足之处是。