硫是一种生命元素,组成某些蛋白质时离不开它。SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学设计了如下系列实验:
(1)为验证SO2具有还原性。将SO2气体通入溴水中,溴水褪色。写出反应的化学方程式 。
(2)已知SO2与Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验。
①写出A中反应的化学方程式 。
②B装置的作用是 。
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为 。
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案。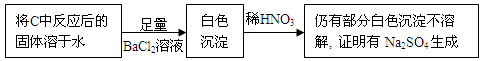
上述方案 (“合理”或“不合理”),简要说明理由 。
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案。
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 |
白色浑浊 |
|
| |
固体部分溶解,产生气泡 |
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。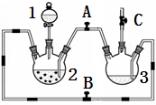
(1)稀硫酸应放在 中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色为 。试分析实验开始时排尽装置中空气的理由 。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是 。
A.用冷水洗
B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗
D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗高锰酸钾溶液体积/mL |
25.52 |
25.02 |
24.98 |
滴定过程中发生反应的离子方程式为 。滴定终点的现象是 。
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。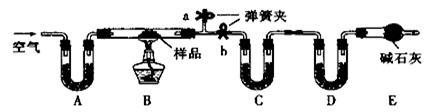
(1)加热前通入空气的目的是 。
(2)装置C、D中盛放的试剂为C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 。
(4)若样品的质量为25.0g,反应后C、D的质量差分别为9.9g、2.2g,由此可知混合物中NaHCO3的质量分数为 。
实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。根据图中装置和现象请回答:
(1)按上图组装好实验装置后,首先进行的操作是 。
(2)丙中发生反应的化学方程式为 。
(3)丁中应选用的干燥剂 ,戊中的反应开始后断开电源,铂丝继续保持红热,说明该反应 (填“吸热”或“放热”)。
(4)戊中发生的主要反应的化学方程式
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4﹣+5HSO3﹣+H+===2Mn2++5SO42﹣+3H2O填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
| A.酸式滴定管(50 mL) |
| B.碱式滴定管(50 mL) |
| C.量筒(10mL) |
| D.锥形瓶 |
E.铁架台
F.滴定管夹
G.烧杯
H.白纸
I.胶头滴管
J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因_______________。
(3)指示剂 _______ (填“需要”或“不需要”)选用,说明理由_______________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
为探究Na2CO3与盐酸的反应原理,设计了如右实验装置。
Ⅰ.步骤如下:
(1)在双通管中装12mL0.5mol/L的Na2CO3溶液,在针筒中装4mL3mol/L的盐酸。
(2)从底部向双通管中推入______mL的盐酸。几乎没有气泡产生,原因是:______________(用离子方程式解释)。
(3)将盐酸全部注入,产生大量气泡。
Ⅱ.此装置相对于往Na2CO3溶液中滴加盐酸,优点在于:_____________________。
Ⅲ.利用此装置往含往Na2CO3和另一种含钠的化合物A的混合液中注入稀盐酸,注入盐酸的体积与产生气体的体积关系如下图,则A的化学式为___________,该混合液中Na2CO3和A的物质的量之比为__________。