地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe + NO3- + 10H+ = 4Fe2+ + NH4+ + 3H2O。
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低。课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是 (化学式)。
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响。
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1 mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等。
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定 (要求所测得的数据能直接体现反应速率大小)。
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示)。
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
| 物理量 实验序号 |
V(2.0mol/L KNO3)/ mL |
|
…… |
| 1 |
a |
|
…… |
| 2 |
a |
|
…… |
| 3 |
a |
|
…… |
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是 。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、。
(3)下列有关步骤⑥的操作中说法正确的是。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则铁矿石中铁的百分含量为。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: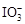 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I-;②KI+I2
>I-;②KI+I2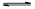 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有(用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL |
0.01mol·L-Na2SO3 溶液的体积/mL |
H2O的 体积/mL |
实验 温度 /℃ |
溶液出现 蓝色时所 需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
t1 |
| 实验2 |
5 |
5 |
40 |
25 |
t2 |
| 实验3 |
5 |
5 |
V2 |
0 |
t3 |
表中数据:t1t2(填“>”、“<”或“=”);表中V2=___________mL
某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠含量,用如图所示装置.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3).
试回答:
(1)烧瓶B中盛,试管C中盛.
(2)有同学认为可以省去某些装置,你认为怎样:
能否省去乙装置?(填“能”或“不能”),理由是
(3)有同学认为还必须加入某些装置,你认为怎样?(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用
(4)丁装置中冰水的作用是.
某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:
①480 mL 0.5 mol/L 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________
_________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意
。
某化学兴趣小组利用图一装置制取氨气并探究氨气的有关性质。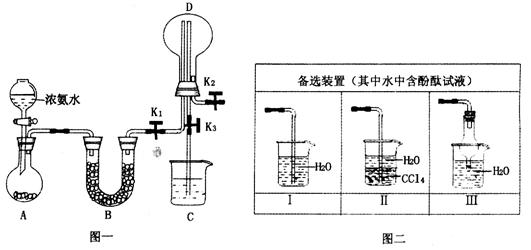
(1)装置A中烧瓶内试剂可选用________(填序号)
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱
(2)若探究氨气的溶解性,需在K2的导管末端连接图二装置中的_____装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________
___________________________________________________________________________。
(3)若探究氨气的还原性,需打开K1、K2,K3处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成气体必须通过盛有____________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为___________________________________;
③从K3处导管逸出的气体中含有少量Cl2,则C装置中应盛放_________溶液(填化学式),反应的离子方程式为____________________________________。