运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ/mol。在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
N2(g)+CO2(g) △H="Q" kJ/mol。在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
 时间 时间浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)=______,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q______0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是______(填选项编号)。
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应:
NO+CO N2+CO2(有CO) 2NO
N2+CO2(有CO) 2NO N2+O2(无CO)
N2+O2(无CO)
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出C2H6与NO2发生反应的化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为 。
用乙烯、甲苯、淀粉三种原料合成高分子H的路线如下:
 |
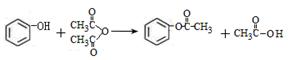
已知:Ⅰ.
Ⅱ.同一个碳原子上连接两个—OH不稳定,1mol B、E都可以和足量的钠反应产生1molH2 ,E可以和NaHCO3反应且E的核磁共振氢谱有四组峰,峰面积之比为1:1:1:3。
请回答下列问题:
(1)A的名称是,C中官能团的名称是。
(2)A→B的反应条件是,E→F的反应类型是。
(3)G→H属于加聚反应,G的结构简式为。
(4)I与过量银氨溶液反应的化学方程式是。
(5)符合下列条件的C的同分异构体(包括C)有种。任写出其中一种能和过量NaOH 溶液按物质的量之比为1:3反应的同分异构体的结构简式为 。
①属于芳香族化合物; ②能与FeCl3溶液发生显色反应;
某同学从网络上了解到菠菜中富含可溶性的两类正盐:草酸盐和碳酸盐。该同学欲用实验验证这一事实并检测其中草酸盐的含量。查阅资料得知草酸(H2C2O4)是一种二元有机弱酸,具有较强的还原性;草酸钙(CaC2O4)不溶于水能溶于稀硫酸。请回答下列问题:
(1)该学生将菠菜研磨成粉末、热水浸泡、过滤得到澄清溶液A。研磨菠菜使用的实验仪器的名称为。
(2)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液。 |
①出现白色沉淀,说明菠菜中 。 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中。 |
②。 |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液。 |
③。 |
(3)欲准确测定菠菜中草酸盐的含量
①操作:取m g菠菜样品,将其中草酸盐全部转化为CaC2O4沉淀分离出来置于烧杯中,用过量的稀硫酸完全溶解后,溶液转入中并加水配制成250mL溶液。每次移取25.00mL该溶液于锥形瓶中,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。KMnO4滴定实验时发生的离子方程式为。
②计算:菠菜中草酸盐(以C2O42-计算)的质量分数为(可以只列式不化简)。
③误差分析: 下列操作会使测定结果偏高的是。
A.配制溶液时未洗涤烧杯和玻璃棒就加水定容
B.锥形瓶未干燥就加入待测液进行滴定
C.未用标准液润洗就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失
E.滴定后俯视读数
已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。
[化学——有机化学基础]有机物A出发合成E和F,有如下转化关系。请回答: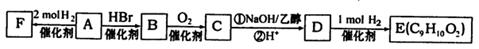
(1)已知F是一种芳香醇,分子中无甲基,则A的结构简式为。
(2)C→D中的反应类型有,反应①的化学方程式为。
(3)已知反应RCH=CHR' RCOOH+R'COOH,将A在此条件下反应得到两种酸X、Y,其中X为芳香族化合物,则X的结构简式为,名称是。
RCOOH+R'COOH,将A在此条件下反应得到两种酸X、Y,其中X为芳香族化合物,则X的结构简式为,名称是。
(4)从A到D变化中,A→B反应的目的是。
(5)若F的同分异构体遇FeCl3溶液显紫色,核磁共振氢谱显示分子中有四种不同的氢原子,则符合此条件的F的同分异构体的结构简式为。
【化学——化学与技术】合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分。请回答下列问题:
(1)右图是工业制硫酸的流程示意图: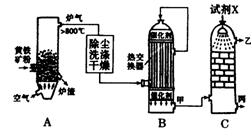
①设备A的名称为。
②试剂X为。
③B设备中热交换器的作用是。
(2)工业制硝酸时,酸吸收塔中的水吸收NO2是放热反应,为使NO2更好被吸收,可采取措施是;工业上用Na2 CO3溶液吸收NO2的化学方程式为。
(3)工业合成氨的化学方程式为,选择天然气做为合成氨原料气的优点是。