实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100ml 0.10mol·L-1NaOH标准溶液,计算需称量 g氢氧化钠固体。
(2)取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
① 滴定达到终点的标志是 。
② 根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
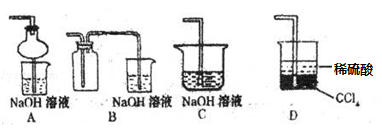
③ 排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有: 。
| A.滴定终点读数时俯视读数 |
| B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗 |
| C.锥形瓶水洗后未干燥 |
| D.称量NaOH固体中混有Na2CO3固体 |
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:甲同学利用Al、Fe、Mg和2 mol/L的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg |
反应快慢:Mg>Al>Fe |
反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是_______________________;要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5 mol/L及2 mol/L的足量稀H2SO4反应,通过________可以说明浓度对化学反应速率的影响。
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)===P4O10(s)ΔH1=-2983.2 kJ·mol-1①
P(s,红磷)+5/4O2(g)="==1/4" P4O10(s)ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为 。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。)
右图是硫酸试剂瓶标签上的内容。
(1)该硫酸的物质的量浓度为 ;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
①需要该硫酸的体积为 mL;
②实验所用到的玻璃仪器除烧杯、玻璃棒外,还有 ;
③配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列 。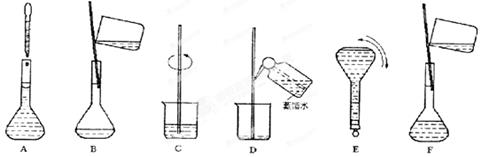
④该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是
| A.量取浓H2SO4时仰视刻度 |
| B.容量瓶洗净后未经干燥处理 |
| C.没有将洗涤液转入容量瓶 |
| D.定容时仰视刻度 |
I、如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题: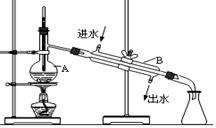
(1)装置中仪器A的名称是 。
(2)请指出上图中的两处明显错误: 、 。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是 。
II、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 升华 C 结晶 D 分液 E 蒸馏 F 过滤
(1) 分离饱和食盐水与沙子的混合物;
(2) 从硝酸钾和氯化钠的混合液中获得硝酸钾;
(3) 分离水和汽油的混合物;
(4) 分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(2)B中试剂为 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅱ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
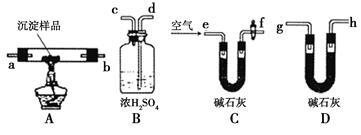
(4)实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是 。
(5)各装置连接顺序为 e→ →h。(填字母序号)
(6)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 。
(1)工业制备硝酸流程如图1: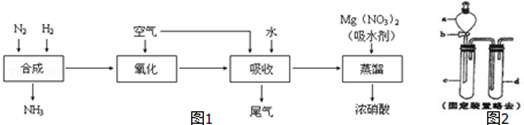
①上述尾气中的NO一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为 .
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶、温度计、蒸馏烧瓶外,还需的玻璃仪器有 .
(2)某兴趣小组采用如图2装置制取并探究SO2气体的性质.
①下列实验方案适用于如图2所示装置制取所需SO2的是 (填序号)
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4
②将SO2通入到以下有颜色的溶液中,溶液的颜色均褪去,其中属于漂白的是 。
A.紫色高锰酸钾溶液 B.氯水 C.品红溶液 D.红色酚酞溶液
③证明c中生成气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液 后,再 (填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2.
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是 (填序号)