生活中有很多现象都蕴藏着化学秘密,如果你是一个细心的人,就一定会发现很多有趣的事.
(1)煤气灯曾是十八世纪的主要照明工具,但有一个奇怪的事引起了不少人的注意,那就是在有些煤气灯的附近,树叶比其他树要早落好长时间,但这个问题一直到1901年才由俄国的植物学家奈刘波夫证实是煤气灯产生的一种气体在作怪,你认为这种气体可能是 .
(2)为了证明你的判断,如图1是一位同学做的实验及其装置: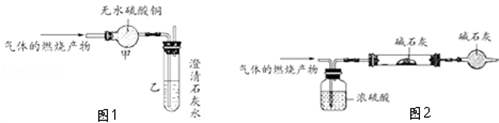
如果实验时无水硫酸铜变蓝色,澄清的石灰水变浑浊;你认为通过以上实验可以得出的结论是 .
(3)若要进一步得出该分子的组成,如图2是另一个同学的实验及其装置.要达到实验的目的,需要下列哪些数据 .
①此气体的质量
②浓硫酸的增重
③硬质玻璃管的增重
④干燥管的增重
⑤此气体的体积(标准状况下的)
(4)将这种气体在高温高压条件下与苯甲醛按一定比例混合,结果发现苯甲醛的质量和性质都没有发生变化,且还得到了一种白色固体.试推测苯甲醛的作用是 .得到的白色固体是 ,发生的反应是 (填反应类型).
某学生为测定未知浓度的硫酸溶液,实验如下:以0.14mol/L的NaOH溶液滴定上述稀H2SO420.00mL,滴定终止时消耗NaOH溶液16.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 20.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写):E—()—D—()— ()—()—F。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。
。
(2)用标准的NaOH滴定未知浓度的盐酸 ,选用酚酞为指示剂,造成测定结果偏高的原因可能是_________。
,选用酚酞为指示剂,造成测定结果偏高的原因可能是_________。
A.配制标准溶液的氢氧化钠中混有NaCl杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
F.开始实验时碱式滴定管尖嘴部分有气泡,在滴定过程中气泡消失,则测得盐酸浓度
(3)计算待测硫酸 溶液的物质的量浓度mol/L(计算结果保留二位有效数字)
溶液的物质的量浓度mol/L(计算结果保留二位有效数字)
某同学想通过利用下图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物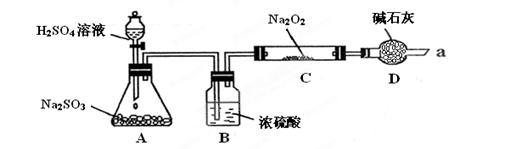
请分析:Ⅰ.装置B的作用装置D的作用
Ⅱ.如何检验反应中是否有O2生成
Ⅲ.对C中固体产物提出如下假设:假设1:只有Na2SO3假设2:只有Na2SO4
假设3:
(1)若按假设2进行,反应方程式为
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:假设2成立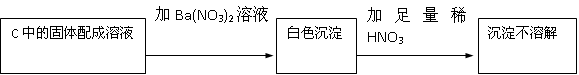
该方案是否合理(填“是”或“否”),理由是
(3)若假设2成立,反应前后C管增加6.4g ,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
(10分)某同学为研究氧化铁与过量炭粉的反应,进行如下实验:
①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接。
②通一段时间纯净、干燥的氮气。
③夹紧T处弹簧夹,然后点燃酒精灯,加热一段时间后,澄清石灰水变浑浊。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
⑴实验步骤①加入药品前,先进行的操作是。
⑵实验步骤②通入N2的目的是,实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_____________________________________________________________。
⑶经计算,参加反应的碳元素质量为 g。
⑷反应生成的气体是______________________,
该实验的化学方程式为:__________________________________________________。
⑸该实验设计存在不合理之处,请指出并说明改进方法 _________
_______________________________________________________________________。
(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
| A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。 |
| B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
| C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。 |
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
| V1 |
V2 |
||
| ① |
20.00 |
0.50 |
22.60 |
| ② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是,一定不含有的物质是,可能含有的物质是(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加溶液的方法来检验。
(2)写出步骤③中的离子方程式。