短周期元素形成的常见非金属固体单质 A 与常见金属单质 B,在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和气体 E,D 既能溶于强酸,又能溶于强碱。E 在足量空气中燃烧产生刺激性气味的气体 G,G 在大气中能导致酸雨的形成。E 被足量氢氧化钠溶液吸收得到无色溶液 F。溶液 F 在空气中长期放置发生反应,生成物之一为 H。H 与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质 A 的元素在周期表中的位置 。
(2)B 与氢氧化钠溶液反应的化学方程式为:_____________________。
(3)G 与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成 2mol 二氧化氯时,转移电子___________mol。
(4)溶液 F 在空气中长期放置生成 H 的化学方程式为:________________________。
(5)H 的溶液与稀硫酸反应产生的现象为_______________________。
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅰ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的氢气和二氧化碳仅反应反应Ⅰ,实验测得反应物在不同起始投入量下,
体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。
① 氢气和二氧化碳的起始的投入量以A和B两种方式投入
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3摩尔氢气和1.5摩尔二氧化碳,该反应10分钟时达到平衡:A.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3摩尔氢气和0.9摩尔二氧化碳、0.6摩尔甲醇、x摩尔水蒸气,若使反应在开始时正向进行,则x应满足的条件是 。
b.在此条件下,系统中甲醇的浓度随反应时间的变化趋势如图2所示,当反应时间达到3分钟时,迅速将体系温度升至600K,请在图2中画出3~10分钟内容器中甲醇的浓度变化趋势曲线。
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应。图3是甲醇燃料电池的模型。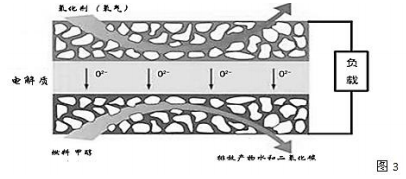
①写出该燃料电池的负极反应式 。
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 摩尔。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下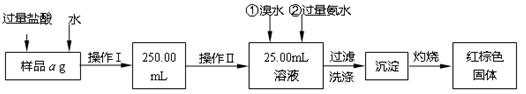
步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 ;若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不再用盐酸,为什么?
(2)选择的还原剂时否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉cmol/L高锰酸钾溶液bmL,则样品中铁元素的质量分数是 。
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。完成下列填空:
(1) Se和浓硝酸反应的还原产物为一氧化氮和二氧化氮,且一氧化氮和二氧化氮的物质的量比为1:1,写出硒和浓硝酸的反应方程式 。
(2)已知:Se+2H2SO4(浓)→ 2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O → Se+2SO32-+4H+
SeO2、 H2SO4(浓)、 SO2的氧化性由强到弱的顺序是 。
(3)回收得到的二氧化硒的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 → Na2S4O6+2NaI配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量二氧化硒样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中二氧化硒的质量分数为 。
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标况下的密度为0.759g/L,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题: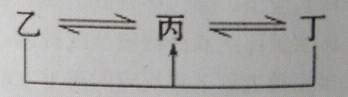
(1)单质B 的结构式: 。
(2)F元素周期表中的位置: 。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34.其中庚的熔沸点比辛 (填“高”或“低”),原因是 。