五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成化合物CE。下列说法正确的是
A.五种元素中原子半径最大的是E,最小的是A
B.A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物
C.E最高价氧化物对应水化物化学式为H2EO4
D.C的单质在空气中燃烧产物的化学式为C2O
既能使溴水和酸性高锰酸钾溶液褪色,又能跟银氨溶液溶液反应的物质是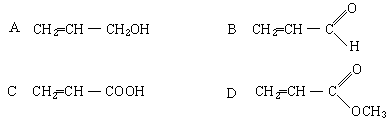
下列关于同系物的说法错误的是
| A.同系物能符合同一通式 |
| B.同系物具有相同的最简式 |
| C.相邻的同系物在组成上相差一个CH2原子团 |
| D.同系物的化学性质基本相似,物理性质随着碳原子数增加而有规律的变化 |
从溴水中萃取溴,下列试剂中能用做萃取剂的是
| A.乙酸 | B.水 | C.四氯化碳 | D.酒精 |
在实验室中通常以加热乙醇和浓硫酸的混合液来制取乙烯,在这个反应里浓硫酸
| A.既是反应物又是脱水剂 | B.既是反应物又是催化剂 |
| C.既是催化剂又是脱水剂 | D.仅是催化剂 |
实验室制取乙烯和石油分馏的实验操作,下列说法正确的是
| A.反应容器(烧瓶)加入少许碎瓷片防止暴沸 |
| B.都用到了冷凝管 |
| C.都用到温度计,且温度计的位置相同 |
| D.都是属于化学变化 |