(1 7分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正________v逆(填“>”“<”或“="),A、B两点反应的平衡常数较大的是_________(填“A”或“B")。
(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,试分析原因:________.0.1mol·L-1NH4NO3溶液中离子浓度由大到小的顺序是________,常温下NO2-水解反应的平衡常数Kh="________mol"  (保留两位有效数字)。
(保留两位有效数字)。
(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数=1.7×10-5mol·L-1)
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
反应m A+n B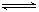 p C在某温度下达到平衡。
p C在某温度下达到平衡。
⑴若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
⑵若C为气体,且m+ n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
⑶如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
丙烯是重要的化工原料,以丙烯为原料合成某种有机玻璃和油墨材料DAP-A树脂的流程如下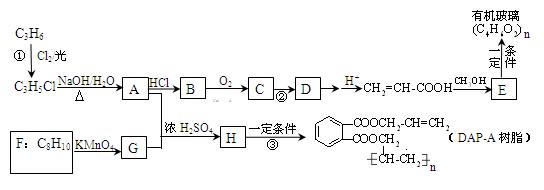
回答问题:
(1)写出下列物质可能的结构简式:B_________________,F_________________。
(2)写出反应类型:反应②______________;反应③____________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2______mol。
(4)写出反应①的化学方程式___________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式。
(6)E的同分异构体中,属于酯类的链状有机物有 、
、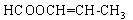 、___________________________________。
、___________________________________。
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。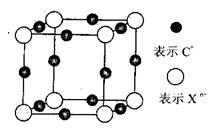
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之间)代替氟利昂作致冷剂,这一做法对环境的积极意义是。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如图: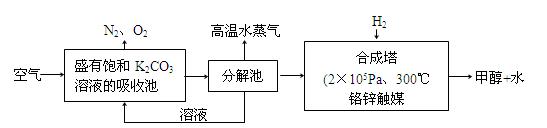
①分解池中反应的化学方程式为:。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式:。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积Ksp分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的溶液,实验时除测定温度、压强和空气的体积外,还需测定。