一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.要求同学们进行探究:确认这瓶溶液是什么溶液?
【提出猜想】王老师提示:这瓶无色溶液只能是下列四种溶液中的一种:
①硫酸镁溶液 ②硫酸钠溶液 ③硫酸溶液 ④硫酸铵溶液
【查阅资料】(1)常温下,相关物质的溶解度如下:
| 物质 |
MgSO4 |
Na2SO4 |
(NH4)2SO4 |
H2SO4 |
| 溶解度 |
35.1g |
19.5g |
75.4g |
与水以任意比互溶 |
(2)(NH4)2SO4的水溶液显酸性.
【实验探究】(1)通过查阅资料,小明同学认为猜想________(填序号)不成立,原因是________________________________________________________________________.
(2)为确定其他几种猜想是否正确,小明同学继续进行探究:
| 实验操作 |
实验现象 |
实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴________溶液 |
溶液中有白色沉淀生成 |
猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟标准比色卡对照 |
溶液pH小于7 |
猜想③成立 |
小雅同学认为小明的实验操作②的结论不正确,她的理由是________________________.
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 |
实验现象 |
实验结论 |
| 取该溶液少许于试管中,________ |
________ |
猜想④成立,该反应的化学方程式为________ |
比较和归纳是学习化学的常用方法。某学习小组的同学在下图所列出的实验装置的基础上,对二氧化碳的制取进行研究。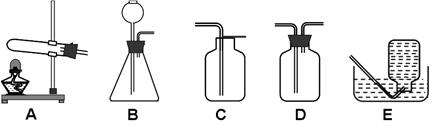
(1)确定气体发生装置应考虑的因素是和。
(2)甲同学用大理石与稀盐酸反应制取二氧化碳气体,化学方程式是:
,要得到一瓶干燥的二氧化碳气体,所选装置的连接顺序是(填字母),可选用作干燥剂。
(3)加热固体碳酸氢钠或固体碳酸氢铵都能产生二氧化碳气体,化学反应方程式分别是:2NaHCO3  Na2CO3+ H2O+ CO2↑; NH4HCO3
Na2CO3+ H2O+ CO2↑; NH4HCO3  NH3↑+ H2O+ CO2↑ 乙同学选择加热碳酸氢钠的反应制取二氧化碳,则发生装置应选用(填字母)。他不选择加热碳酸氢铵制取二氧化碳的理由是
NH3↑+ H2O+ CO2↑ 乙同学选择加热碳酸氢钠的反应制取二氧化碳,则发生装置应选用(填字母)。他不选择加热碳酸氢铵制取二氧化碳的理由是
我们知道二氧化碳与水反应生成碳酸,那么二氧化硫与水是否也能反应生成一种酸呢?某实验小组对此进行探究,设计的探究过程如下。请你回答其中的有关问题:
(1)做出假设:;
(2)设计方案:先验证水能否使蓝色石蕊试纸变色,再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色,最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红,实验装置和药品如图:
(3)查阅资料:你认为该实验小组需要掌握的资料内容中应包括(填序号)
①二氧化硫易溶于水②酸能使湿润的蓝色石蕊试纸变红③SO2不与浓硫酸反应④二氧化硫有毒,能与碱溶液反应生成盐和水
(4)实验:
①实验过程中装置C内石蕊试纸的颜色始终没有变化,这说明。
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红。此现象说明,此过程中反应的化学方程式为。
③装置E的作用是。
(5)结论:原假设(填“成立”或“不成立”)
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题1] 该氢氧化钠溶液是否变质了呢?
[实验探究1]
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 |
氢氧化钠溶液一定变质了。 |
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质。 猜想2:氢氧化钠溶液全部变质。
[查阅资料] 氯化钡溶液呈中性。
[实验探究2]
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,并不断振荡。 |
有生成。 |
说明原溶液中一定有碳酸钠。 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有。 |
[实验结论] 该氢氧化钠溶液(填“部分”或“全部”)变质。
[反思与评价]
在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钡溶液,你认为该方案(填“可行”或“不可行”),理由是
[理解与应用] (1) 氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例:。
(2)取上述部分变质的氢氧化钠溶液100g,向其中加入足量的氢氧化钡溶液,完全反应后得到1.97g白色沉淀,求上述氢氧化钠溶液中碳酸钠的质量分数。(写出计算过程)
在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
【实验目的】铁生锈条件的探究。
【实验内容】取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。
实验①实验②实验③
【实验现象】实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。
【实验结论】铁生锈实际上是铁与空气中的(填名称)发生反应的结果。
【实验思考】
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的。
(2)该实验创新之处在于:可根据铁丝表面的铁锈和两种现象来判断铁丝反应进行的情况。
(3)铝比铁活泼,但铝难腐蚀,原因是。
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什么合理的建议。(答一点即可)
某化学兴趣小组利用下图装置探究制取气体的原理、方法及性质。结合装置图,回答下列问题:
A B C D E
(1)写出图中标号仪器的名称:a。
(2)用双氧水和二氧化锰制取氧气时,可选用的发生装置是(填上图字母),可选用C装置收集氧气,其原因是。
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),应选择的发生装置是(填上图字母)。
(4)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质。
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
(填字母)。
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用I、Ⅲ装置制得二氧化碳并验证其性质。实验室制取二氧化碳的化学方程式是;若要证明二氧化碳气体通入水中产生的物质是碳酸,应向烧杯的水中加入几滴。