(15分)实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下: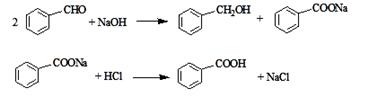
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃
④苯甲醇沸点为205.3℃
实验步骤如下: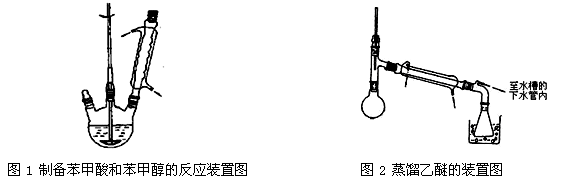
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为 。
溴被称为“海洋元素”。已知Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:
步骤1:将海水蒸发浓缩除去粗盐
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2。
步骤3:向步骤2所得水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。
(1)步骤3中的反应的离子方程式。
(2)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是溴元素。
(3)步骤5中萃取和分液所需要的主要玻璃仪器为。 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。

 ①反应过程中需要对A容器加热,加热的方法是。
①反应过程中需要对A容器加热,加热的方法是。
图中冷却水应从B的口进入(填“a”或“b”) 。
②C中加冰的目的是。
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中(填“实线”或“虚线”)。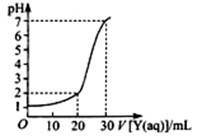
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是和。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于(填仪器名称)中,用蒸馏水稀释10倍。
B.用(填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入(填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视;终点现象是。
②误差分析:下列操作中能使测定结果偏高的是。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是。
如图是某同学设计的放热反应的观察装置。
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:
(1)实验中观察到的现象是。
(2)该实验中在安装好装置后必须进行的第一步实验操作是。
(3)实验中反应的化学反应方程式是。
(4)说明CaO、H2O的能量之和Ca(OH)2的能量。(填“>”、“<”或“=”)
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象?。
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下: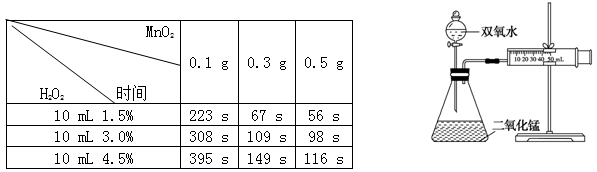
分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择.
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________
理由是。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入指示剂,进行滴定。滴定至终点,记录数据。
④重复以上过程2次。
试回答下列问题:
(1)应将NaOH溶液注入下图中的(选填“左”或“右”)中。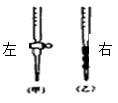
(2)该小组在步骤①中的错是,
由此造成的测定结果(偏高、偏低或无影响)。
(3)下图是某次滴定时的滴定管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为mL。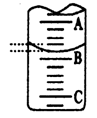
(4)该滴定操作中③应选用的指示剂是,滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视?,如何确定终点?。
(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.52 |
25.42 |
| 第二次 |
20.00 |
4.07 |
29.17 |
请计算待测烧碱溶液的浓度为。