随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的
△H 0(填“>”、“=”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。
(4)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。
①该工艺中能量转化方式主要有 (写出其中两种形式即可)。
②电解时其中b极上生成乙烯的电极反应式为 。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)K1∆H1 < 0(I)
NaNO3(s)+ClNO(g)K1∆H1 < 0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H2 < 0(II)
2ClNO(g) K2∆H2 < 0(II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内 (ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=mol,NO的转化率α1=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是。
(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=mol,NO的转化率α1=。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K2(填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是。
氢气是一种清洁、高效的新型能源。
I.用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是。
II.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应。测得CO2的浓度随时间变化的图像如下图: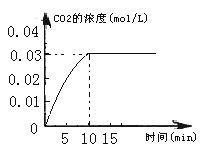
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为;
(3)下列改变中,能使平衡向正反应方向移动的是。
| A.升高温度 | B.增大压强 |
| C.增大H2O(g)的浓度 | D.减少CO2(g)的浓度 |
(4)保持温度不变,若起始时c(CO)=1mol·L—1, c(H2O)="2" mol·L—1,反应进行一段时间后,测得H2的浓度为0.4 mol·L—1。通过计算,判断此时该反应进行的方向并说明理由:。
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2) 放电的电极反应式为____________。
放电的电极反应式为____________。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因________。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是。假设空气中N2和O2的体积比为4︰1,1300℃时,1mol空气在某密闭容器内反应达到平衡时,测得NO为8×10-4mol,该反应的平衡常数K≈。
(3)汽车燃油不完全燃烧时生成CO,有人设想按下列反应除去CO:2CO(g)=C(s)+O2(g) △H>0,该设想能否实现?(填“能”或“不能”),原因是。
(4)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理:。
(5)某科研机构设计传感器检测CO的含量,其工作原理示意图如下: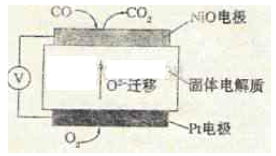
Pt电极上发生的是反应(填“氧化”或“还原”);
写出NiO电极的电极反应式。
有难溶于水的粉末状固体样品,可能含有Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种,研究小组通过实验确定样品的成分.
【查阅资料知】① Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
【注】金属离子的起始浓度为0.1 mol·L-1
【实验步骤】
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀.
请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为.
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是.
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是.
(4)Ⅳ中加NaClO的目的是.
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为;若电路中有0.1mol电子通过,则理论上阴极质量增重g.
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合为
(用化学式表示).