(14分)四氯化锡用作媒染剂和有机合成上的氯化催化剂,实验室制备四氯化锡的反应、装置示意图和有关信息数据如下:
有关信息数据:①将金属锡熔融,通入干燥氯气进行反应。生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃。⑧无水四氯化锡暴露于空气中与空气中的水分反应生成白色烟雾。有强烈的刺激性。回答下列问题:
(1)仪器C的名称是 ,仪器D的作用是 。
(2)制备无水四氯化锡各装置的连接顺序是( )一( )一( )一( )一( )(填装置序号)。
(3)试剂E和F分别是 、 ,装置V的作用是 。
(4)若无装置V存在,在装置Ⅲ中除生成SnCl4外,还存在的副产物的化学式为 。
(5)实验制得的SnCl4中因溶解了C12而略显黄色,提纯SnCl4的方法是 。
(6)若Ⅱ中用去锡粉5.95 g.反应后,Ⅲ中锥形瓶里收集到12.0 g SnCl4,则SnCl4的产率为 (结果保留三位有效数字)。
实验室常见的几种气体发生装置A、B、C所示:

 (1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是。检查C装置气密性是否良好的操作方法是
(1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是。检查C装置气密性是否良好的操作方法是
。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是
(填序号,下同)
①密度②颜色③溶解性④热稳定性⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的。
①CO2②NO③Cl2④H2
下图Ⅰ、II、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置,(填序号)用离子方程式表示制取氯气的反应原理是。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从口通入。用化学方法检验氯气收集满的方法是。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为mol/L。
Ⅰ.实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气,其反应的化学方程式:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。问:
CaCl2+2NH3↑+2H2O。问:
(1)实验室制取(不包括收集)氨气的装置,可选用制取____(H2或O2或CO2)的装置。其理由是____,收集氨气可用____法。
(2)若要制得干燥的氨气,可用____做干燥剂。
(3)写出氨气与氧气反应的化学方程式:____。
(4)将氨气溶于水制成氨水,应选用下图装置中的____(填序号)。
A B C
ⅠⅠ.实验室合成氨装置如右图所示,试回答
(1)装置甲的作用是:
①,②,③。
(2)从乙处导出的气体是,检验产物的简单化学方法
。
Ⅲ.实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:
NaNO2+NH4Cl=NaCl+N2↑+2H2O↑+Q
实验装置如下图所示,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是_______(填写编号)
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(2)加热前必须进行的一个操作步骤是___________,加热片刻后,即应移去酒精灯以防反应物冲出,其原因是。
(3)收集N2前,必须进行的步骤是(用文字说明),收集N2最适宜的方法是(填写编号)。
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
从固体混合物A出发可以发生如下框图所示的一系列变化: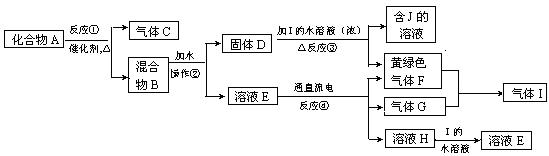
(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)
A B C
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的是 ,瓶II中盛放的是 。
 |
(5)实验中必须吸收多余的气体,以免污染空气。下图是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是 (填选项字母)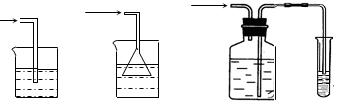
A B C
某化学课外活动小组设计了下图所示的实验装置,进行“氨的催化氧化”实验(固定装置去)。
(1)A中使用的药品是等物质的量的碳酸氧钠和碳酸氢铵,则在下列仪器中,A中未画出的仪器有(填序号)。
①分液漏斗②试管③烧瓶④酒精灯⑤导管⑥橡胶塞
(2)与装置B中的药品发生反应的物质有(填化学式),装置c中发生催化氧化反应的化学方程式为
(3)若A、B中药品足量,则装置D中可以观察到的现象自。
(4)指导老师从安全与环保角度考虑.指出该装置有两处明显的缺陷,请你提出修改建议:。