(1)下列各组物质中:①O2和O3 ② 和
和 ③H2O和D2O ④CH3CH3和CH3CH2CH2CH3 ⑤CH3-CH2-OH和CH3-O-CH3
③H2O和D2O ④CH3CH3和CH3CH2CH2CH3 ⑤CH3-CH2-OH和CH3-O-CH3
互为同位素的是 ;互为同素异形体是:_____;互为同分异构体是: 。
(2)选用下列物质的序号填空:①二氧化硫 ②二氧化碳 ③氟利昂 ④氮氧化物
会破坏臭氧层的物质 ;过量会导致温室效应加剧的物质 ;造成酸雨的物质 ;导致光化学烟雾的物质是 。
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L层电子数是K层和M层电子数之和,C是所有短周期元素中半径最大的元素、C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应。试解答下列问题:
(1)B元素的简单离子的结构示意简图为
(2)A、D、E元素的名称分别为、、。
(3)E元素在周期表中的位置是第周期族。
(4)A B C三种元素形成的化合物的电子式为:
(5)五种元素的简单离子半径从大到小的顺序是(用元素离子符号填写)
(6)五种元素中,得电子能力最强的是,失电子能力最强的是(填元素符号)
I.现有下列物质:
1、CI2 2、Na2O2 3、NaOH 4、HCl 5、H2O26、MgF2 7、Mg3N2
(1)只有离子键构成的物质是(2)只有极性键构成的物质是
(3)只有非极性键构成的物质(4)有极性键和非极性键构成的物质是
(5)有离子键和极性键构成的物质是(6)有离子键和非极性键构成的物质是
(7)属于离子化合物的是(8)属于共价化合物的是
II.能够说明可逆反应2NO2 N2O4达到平衡状态的标志是_____________
N2O4达到平衡状态的标志是_____________
①单位时间消耗2mol NO2的同时,生成1 mol N2O4 ②恒温恒压下,混合气体的密度不变 ③NO2和N2O4的浓度之比为2∶1 ④混合气体的颜色不变 ⑤单位时间消耗4mol NO2的同时,消耗2mol N2O4
已知乙烯能发生以下转化: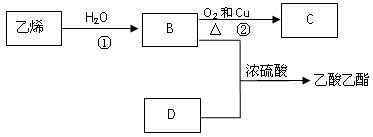
(1)乙烯的结构简式为:
(2)图中浓硫酸所起作用是______________________
(3)写出反应的化学方程式
①:反应类型:
②:反应类型:
、(1)有机化合物的结构简式可进一步简化,如:
写出下列物质的分子式:
①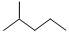 分子式用系统命名法对该有机物进行命名_______________
分子式用系统命名法对该有机物进行命名_______________
② 分子式③
分子式③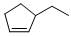 分子式
分子式
(2)除去下列物质中的杂质(括号内为杂质),填入所用试剂和分离方法。
①乙烯(SO2),试剂,分离方法
②苯(溴),试剂,分离方法
酸牛奶中含有乳酸,其结构简式为:CH3CH(OH)COOH试写出:
(1)请你写出该有机物所含官能团的名称:________________________。
(2)乳酸跟少量Na2CO3反应的化学方程式:_________________________________________。
(3)乳酸跟足量Na反应的化学方程式:_____________________________________________。
(4)乳酸与乙醇酯化反应的方式:。