A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第___________周期第___________族。
(2)E元素形成的氧化物对应的水化物的化学式为________________。
(3)元素C、D、E形成的离子半径大小关系是________>________>__________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程________________________。C、D还可形成化合物D2C2,D2C2含有的化学键是__________________。
(5)由A、B、C三种元素形成的离子化合物的化学式为______________,它与强碱溶液共热,发生反应的离子方程式是____________________。
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为______________________(化学式用具体的元素符号表示)。
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:(1)稀硝酸和Cu反应的化学方程式为。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①据实验现象写出发生反应的离子方程式:。
②导致实验过程中溶液pH略有上升的可能原因是。
③解释乙同学的实验现象。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:。
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为,反应中消耗1mol的MnO4—时转移电子数为。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是,又变为棕黄色的原因是。
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。



试回答:
(1)B装置中Cu电极上的电极反应式为,D装置中Fe电极上的电极反应式为。
(2)D装置中的实验现象有,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是(填B或C)。
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL)(标况下) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,你认为原因是。
(2)4~5 min时间段的反应速率最小,你认为原因是。
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2OB.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末
你认为可行的是(填编号)。
如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题: 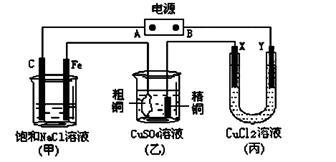
(1)在电源中,B电极为极(填电极名称,下同);丙装置中Y电极为极。
(2)在甲装置中,石墨(C)电极上发生反应(填“氧化”或“还原”);甲装置中总的化学方程式是:。
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
L。