【化学 选修2:化学与技术】海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%。
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题。电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如下图所示,电渗析法淡化海水时阴极室可获得的重要化工原料有 。
| 时间 |
4℃ |
10℃ |
20℃ |
35℃ |
55℃ |
90℃ |
| 5分钟 |
0 |
0.2 |
0.4 |
0.7 |
0 |
0 |
| 10分钟 |
0 |
1.0 |
1.3 |
1.2 |
0.1 |
0 |
| 15分钟 |
0.1 |
1.9 |
2.2 |
2.8 |
0.2 |
0 |

(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法。盐田分为贮水池、 池和结晶池,建盐田必须在 处建立(填写序号)。
A.选在离江河入海口比较近的地方
B.多风少雨
C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制。第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下: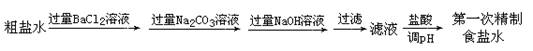
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 |
CaCO3 |
BaSO4 |
BaCO3 |
| 2.6×10-2 |
7.8×10-4 |
2.4×10-4 |
1.7×10-3 |
①检测Fe3+是否除尽的方法是__________________________________________。
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因_______________。
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式__________。
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。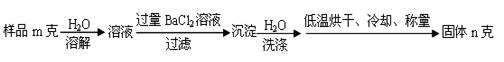
①检验沉淀是否洗涤干净的方法是________________________________;
②样品中NaCl质量分数的数学表达式为_____________________。
下表为元素周期表的一部分,请回答: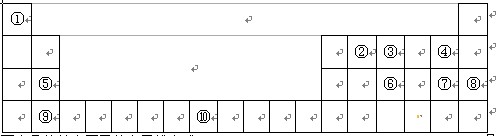
(1)写出⑩的基态原子的电子排布式:。
(2)第一电离能:⑤⑨(填“ > ”、“ < ”或“ = ”)
(3)①~⑩元素中,电负性最大的是(填元素符号,下同),第一电离能最大的是。
(4)③、⑥分别形成的气态氢化物,稳定性较强的是(填化学式,下同),沸点较高的是,原因:。
(5)①与②形成的化合物,其VSEPR模型为;中心原子的杂化方式为
杂化;该分子为分子(填“极性”或“非极性”)。
已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH)l.8 xl0-5,Ka(HSCN)0.13
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。
反应开始时,两种溶液产生CO2的速率明显不同的原因是;
反应结束后所得溶液中c(SCN-)____c(CH3COO-)(填“>”,“=”或“<”)。
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____(填“有”或“没有”),筒述理由:。
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: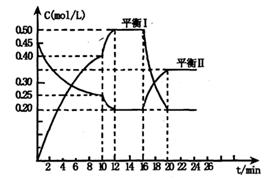
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=;
(2)根据图示可确定x:y=;
(3)0~l0min容器内压强____(填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是;第16min引起曲线变化的反应条件可能是____;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1K2(填“>”“=”或“<”)
新型锂离子电池材料Li2 MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2 MSiO4有两种方法:
方法一:固相法,2Li2SiO3+ FeSO4 Li2FeSiO4 +Li2SO4 +SiO2
Li2FeSiO4 +Li2SO4 +SiO2
方法二:溶胶—凝胶法,
 Li2FeSiO4
Li2FeSiO4
(1)固相法中制备Li2 FeSiO4过程采用惰性气体气氛,其原因是;
(2)溶胶—凝胶法中,检查溶液中有胶体生成的方法是;生产中生成Imol Li2FeSiO4整个过程转移电子物质的量为mol;
(3)以Li2 FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为:Li+ LiFeSiO4 Li2FeSiO4则该电池的负极是____;充电时,阳极反应的电极反应式为;
Li2FeSiO4则该电池的负极是____;充电时,阳极反应的电极反应式为;
(4)使用(3)组装的电池必须先____。
(1)图甲是实验室常用的一种仪器,其名称是____;其主要用途是________;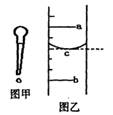
(2)小明用某规格的量筒量取一定体积的液体,液面位置如图乙,则其量得液体体积为______________(用a、b来表示)
(3)下图是某研究性小组设计的一个储气装置图。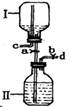
①将气体存于Ⅱ瓶中,下列说法不正确的是。
| A.打开止水夹a,b,将气体从导管d通入,可将气体储存在Ⅱ瓶中 |
| B.作为储气或取气时都无需在C处安装止水夹 |
| C.该装置主要缺陷是C导管上未装止水夹 |
| D.该装置也可用作制取氢气的发生装置 |
②要从该储好气的装置中取用气体,正确操作是:。