(12分)工业上用碘酸盐(碘酸为强酸)制备高碘酸(H5IO6,属于弱酸),并用高碘酸在酸性介质中氧化Mn2+生成MnO4—,其流程如下图所示:
(1)反应Ⅰ是将碘酸钠氧化为不溶于水的Na2H3IO6,该反应的化学方程式为________。
反应Ⅱ得到的是不溶于水的黑色Ag5IO6,过滤Ⅱ的滤液呈________(填“酸”、“碱”或“中”)性。
(2)无色气体的名称为________。白色滤渣的化学式为________。
(3)工业上为降低成本,减少对环境的污染,整个流程需要控制加入氯气和硝酸银的物质的量之比为n(Cl2)∶n(AgNO3)=________。
(4)氧化Mn2+过程中,消耗1 mol H5IO6时,转移2 mol电子,则该反应的离子方程式为________。
实验来源于生活且服务于生活,请回答些列问题:
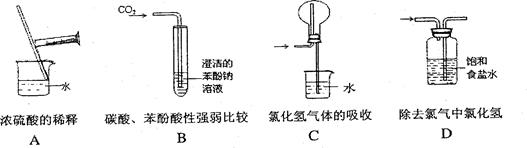
(1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是( )
)
(2)由图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。挤压滴管的胶头,下列与实验事实不相符的是()(注:不考虑导管被堵塞)
A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
(3)设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有
小孔的试管制简易的气体发生器(见图)。若关闭K,不能使反应停止,可将试管
从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是( ) 
A.用二氧化锰(粉末)与浓盐酸制氯气
B.用锌粒与稀硫酸制氢气
C.用碳酸钠固体与盐酸制二氧化碳
D.用碳酸钙(块状)与稀硫酸制二氧化碳
(4)为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
| 物质 |
试剂 |
分离方法 |
|
| ① |
硝酸钾(氯化钠) |
蒸馏水 |
重结晶 |
| ② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
| ③ |
乙醇(水) |
生石灰 |
蒸馏 |
| ④ |
SiO2(Al2O3) |
NaOH溶液 |
过滤 |
A.①② B.①③ C.只有③ D.③④
有一种白色粉末,含有下列阴离子和阳离子中的几种,阴离子:S2- 、MnO4-、NO3-、SO42-、CO32-,阳离子:Na+、Al3+、Ba2+、Fe3+、NH4+,将白色粉末进行下列实验,实验操作及观察到现象如下:
a、取少量粉末加水振荡,现象是:全部溶解,溶液无色透 明;
明;
b、向所得溶液慢慢滴入苛性钠溶液并加热,现象是:无明显现象;
c、取少量粉末加盐酸,现象是:无明显现象;
d、取少量粉末加稀硫酸和稀硝酸混合液,现象是:有不溶于稀硝酸的白色沉淀生成。
根据实验推断:
(1)从a实验中可推断粉末中一定没有________离子;
(2)从b实验中可推断粉末中一定没有________离子;
(3)从c实验中可推断粉末中一定没有________离子;
(4)从d实验中可推断粉末中必定含有________离子;
(5)综上所述,粉末中还可能含有_______ _离子
_离子
配 制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
Ⅰ、请将下述实验步骤中缺少的文字请补充完整
(1)实验中选用的仪器除托盘天平、砝码、镊子、量筒、玻璃棒外还必须用到
仪器。
(2)计算:所需NaOH的质量为g;
(3)称量:用托盘天平称量时,首先将托盘天平调平,将 放在天平的左盘上称量其质量,再添上g砝码后,向左盘加NaOH固体到平衡为止;
(4)溶解:向盛有NaOH的烧杯中加入70mL水并用玻璃棒使其溶解;
(5)转移:将步骤(4)中溶液用玻璃棒 注入容量瓶中,在烧杯中加入少量的水,小心洗涤2—3次后并将洗涤液移入容量瓶中 ;
(6)定容:继续往容量瓶中加水至液面接近刻度线 cm处,改用加水至刻度线,注意视线与保持水平,加盖摇匀。
(7)贮存: 将溶液倒入试剂瓶中保存,贴上标签注明溶液的浓度和配制日期。
如下图甲、乙是电化学实验装置。
(1) 若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为____________________________________________;
②将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为____________________________________________。
(2) 若甲、乙两烧杯中均盛有CuSO4溶液。
① 甲中铁棒上的电极反应式为______________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_____(填写物质的化学式)________g。
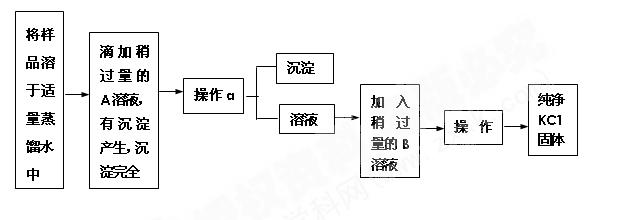
实验室现有一瓶含少量氯化钙的氯化钾,通过下面的实验制取纯净的氯化钾,根据实
验步骤填写下列空白。
(1)加入的A是,检验A是否过量的方法是。
(2)操作a是,用到的玻璃仪器有、 、 。
(3)溶液中加入的B物质是,应加入过量B物质的理由是。
(4)操作b是,其中用到与操作a相同的玻璃仪器是,该仪器在此处的作用是。