有关铝的几个实验如下。请填写下列空白。
实验一 毛刷实验
实验过程如下图。
(1)配制Hg(NO3)2溶液时,为抑制水解,需加入少量的_____。
(2)铝导线放NaOH溶液的目的是除去表面的氧化膜,其化学方程式为_____。
(3)生成白色毛状物的实质是铝发生电化腐蚀生成A12O3,其中作正极材料的是______ (填序号)。
a.O2 b.A1 c.Hg(NO3)2 d.Hg
实验二 探究白色毛状物是否含有结晶水
取适量白色毛状物样品放入仪器X称量,质量为m1 g
(4)仪器X应选用以下哪个装置____________________(填名称)。
(5)上述过程中“冷却"时要在图1所示的装置中进行的原因是______________________.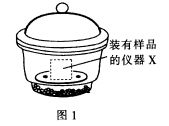
(6)根据所得实验资料,能说明白色毛状物含结晶水的证据是_________(用代数式表示)。
实验三 验证A12O3对石蜡油裂解的催化作用
按图2连好装置,检查装置的气密性,加入5~6 g Al2O3,加热到500℃左右,往Al2O3上滴入石蜡油。已知:石蜡油为液态烷烃混合物(与汽油类似),沸点164~223 ℃。
一定条件下,其裂解产物为乙烯和烷烃的混合物。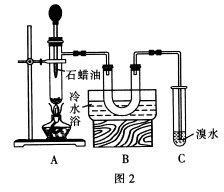
(7)使用装置B的目的是___________________。
(8)需要再补充一个实验才能证明Al2O3对石蜡油裂解反应有催化作用,请简述其实验方案:__________。
(19分)黄铜矿的主要成分是CuFeS2(硫元素显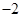 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下: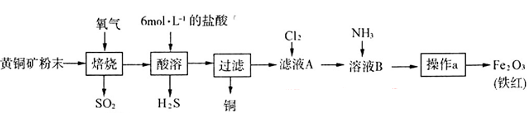
已知: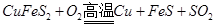
 =
=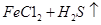
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。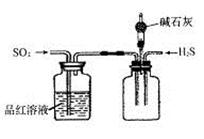
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。 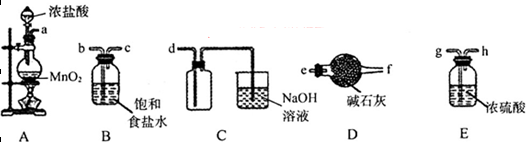
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
(16分)某研究小组拟用粗食盐(含Ca2+、Mg2+、SO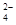 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
试回答下列问题:
(1)工业上一般是利用过量焦炭在高温下还原石英砂来制取粗硅,写出该过程的化学方程式:_______________________________________________________________________。
(2)精制粗盐水所需试剂为①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后顺序是下列的________(填下列各项的序号)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知, ,假设该粗盐水中
,假设该粗盐水中 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
(3)已知SiCl4的沸点是57.6℃,CC14的沸点是76.8℃。在反应器I中得到的SiCl4粗品中含有CCl4,从中得到纯净SiCl4可采用的方法是下列各项中的________(填序号)。
a.蒸馏 b.干馏 c.分液 d.过滤
反应器Ⅱ中发生反应的化学方程式为__________________________________________。
(4)下图是用离子交换膜法电解饱和食盐水的示意图,电解槽中阴极产生的气体是_____。产品A的化学式为____________。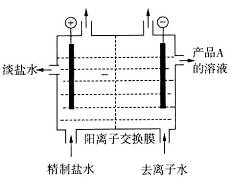
若采用无膜电解槽电解饱和食盐水可制取次氯酸钠,试写出该反应的化学方程式_____。
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。有机物M(分子式:CxHySz)是隐形飞机上吸波材料的主要成分。
M充分燃烧的产物为三种氧化物,写出化学方程式:______________。
Ⅰ定性实验:
某化学兴趣小组为验证M组成元素进行了下列实验:将少量样品放入燃烧管A中,通入一定量O2,用电炉加热使其燃烧,所需装置如图所示(夹持仪器的装置已略去)。
(1)该实验装置连接顺序为____________________。(上述每一组仪器只能使用一次)
(2)D中盛放的试剂是________
(3)能证明有机物含碳元素的现象是_________________________________________。
(4)燃烧管中放入CuO的作用是________________________________。
(5)指出上述中错误的装置:__________________________________________________。
Ⅱ定量实验:
(1)若测产生CO2气体体积,采用如图所示装置,实验结束后①调整量筒内外液面高度使之相同;②冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:________(请填写步骤代号)。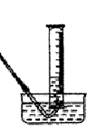
(2)若测产生CO2气体质量,采用沉淀法。下列沉淀剂最好的是
a.0.1mol/LCaCl2溶液 b.0.1mol/L Ca(OH)2溶液
c.0.1mol/L Ba(NO3)2溶液 d.0.1mol/L Ba(OH)2溶液
实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
步骤一:废铜屑制硝酸铜
如图,
用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是,
用该装置制取硝酸铜,好处是。
(2)步骤二中,水浴加热所需仪器有、(加热、夹持仪器、石棉网除外);洗涤的目的是。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为g,化学式为。
大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程: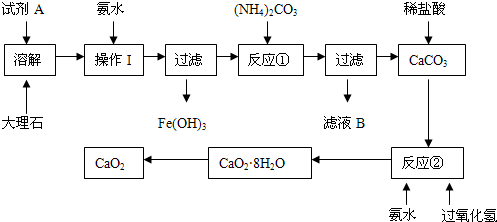
请回答下列问题:
(1)试剂A的名称是;
(2)操作I的目的是;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有;
(4)写出反应②中生成CaO2·8H2O的化学方程式:;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol•L-1的盐酸20.00mL,再用浓度为2.00mol•L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为。