二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,
该反应的化学方程式为:________________________ ________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+ CO(g) CH3OH(g); ΔH = -90.8 kJ·mol-1
CH3OH(g); ΔH = -90.8 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g); ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g); ΔH= -23.5 kJ·mol-1
③CO(g)+ H2O(g) CO2(g)+ H2(g); ΔH= -41.3 kJ·mol-1
CO2(g)+ H2(g); ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
若总反应平衡后,要提高CO的转化率,可以采取的措施是_ __(填字母代号)
a.升温
b.加催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下平衡常数为400 。
CH3OCH3(g)+ H2O(g)某温度下平衡常数为400 。
此温度下,某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol/L) |
0.85 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正___ ___ v逆 (填“>”、“<”或“=”)。
②若从此刻又经过10 min达到平衡, 则这段时间内反应速率v(CH3OH)= ___ ____ _ 。
A、B、C、D、E五种短周期元素,F为第四周期过渡元素,核电荷数依次增加。
| 元素 |
有关性质及结构信息 |
|
| A |
A的一种原子内无中子 |
|
| B |
B原子的电子填充了4个原子轨道 |
|
| C |
C22—离子与电负性最大的元素的单质互为等电子体 |
|
| D |
D是短周期金属性最强的元素 |
|
| E |
C与E同族 |
|
| F |
外围电子排布式为nd2n(n+1)s(n-1) |
|
(1)E2-基态核外电子排布式,D单质的晶胞为体心立方,其配位数是,C的氢化物在同族元素中沸点反常,其原因是。
(2)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的的分子,乙的结构式是。已知1g乙完全燃烧热为46.16 kJ,乙燃烧热的热化学反应方程式是。
(3)甲是由A、B、C三种元素组成的相对分子质量最小的物质。甲的中心原子的杂化方式是。由甲中的两种元素组成,且与甲的电子数相等的物质的分子式是,该物质与C的单质在K2CO3溶液中形成燃料电池的负极反应式为。
(4)分别由A、C、D、E四种元素中的3种组成的两种物质丙和丁在溶液中反应生成气体和沉淀,该化学方程式是 。
(5)C与D形成一种物质戊,将过量戊加入过量F与稀硫酸反应后的溶液,得到红褐色沉淀和气体,发生反应的离子方程式是。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: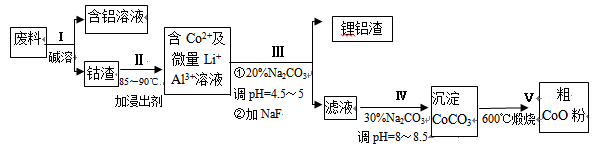
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是
____________________________________________________________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-) - c(H+)=c(HCO3-) + 2c(H2CO3) |
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。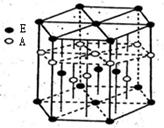
则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为:y<x;②浓度均为0.1mol·L-1A和E溶液,pH:A<E;③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)。
①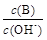 ②
② ③c(H+)和c(OH-)的乘积④OH-的物质的量
③c(H+)和c(OH-)的乘积④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施__________、______________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤 、 。
(6)现有l.60 t硼镁泥,生产MgSO4·7H2O,若生产过程的产率为50%,则能生产出MgSO4·7H2O产品 t (计算结果保留三位有效数字)。(H:1 O:16 Mg:24 S:32)