某品牌纯碱中含有少量氯化钠.某化学探究小组欲测定该品牌纯碱的纯度(即碳酸钠的质量分数)。
Ⅰ.甲组同学设计如图所示实验:
【实验步骤】①组装好如图仪器,并 ;
②称取7.0g样品放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③称量装置C的质量;
④打开分液漏斗旋塞滴入稀硫酸,直到不再产生气泡为止;
⑤再次称量装置C 的总质量; ⑥计算出样品中碳酸钠的质量分数。
【实验分析】(1)A装置中反应的化学方程式为 ;
(2)B装置的作用是 ;
(3)如果没有D装置则所测样品中碳酸钠的质量分数偏大的原因是 ;
(4)称得纯碱样品的质量为7.0g,实验前、后C装置(包含药品)的质量分别为61.2g和63.4g,则该纯碱样品的纯度为 (计算结果精确到0.1%)。
Ⅱ.乙组同学采用生成沉淀的方法来测定样品中纯碱的质量分数,设计了如下实验:
(1)判断加入氯化钡溶液是否过量的合适方法是 (填编号),然后观察现象判断。
A.向混合物X中滴加稀硫酸,若有白色沉淀生成则说明氯化钡已经过量
B.静置混合物X,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,则氯化钡已经过量
(2)判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观察现象判断。
(3)根据实验数据,乙组测得样品中碳酸钠的质量分数为多少?(写出计算过程,计算结果精确到0.1%)。
【实验反思】乙组所测实验数据比甲组更准确,你认为甲组存在较大偏差的原因可能是 。
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
【学生板演】该反应的化学方程式。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究。
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是。
(2)实验方案中也有一个是错误的,错误的原因是。
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化: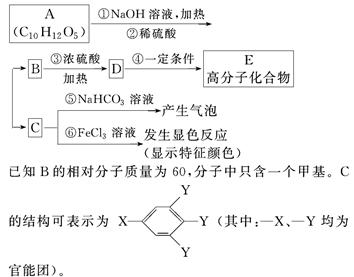
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为XYYY(其中:—X、—Y均为官能团)。
请回答下列问题:
(1)根据系统命名法,B的名称为____________。
(2)官能团—X的名称为____________,高聚物E的链节为____________________________________。
(3)A的结构简式为_____________________。
(4)反应⑤的化学方程式为_________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式______________。
Ⅰ.含有苯环
Ⅱ.能发生银镜反应
Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
甲、乙、丙三位同学为一家化工厂的污水设计排污方案,请你就他们的探究过程回答有关问题.
Ⅰ.首先用pH试纸检测污水的酸碱性.三位同学分别进行如下实验:
甲:取pH试纸于玻璃片上,用玻璃棒蘸取待测液滴在pH试纸行,测得pH<7;
乙:取pH试纸于玻璃片上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
丙:取pH试纸直接浸入待测液中,测得pH<7.
(1)以上三位同学中操作规范的是,污水显.
Ⅱ.利用中和反应原理测定污水中污染物(设为盐酸)的质量分数.
甲、乙两同学设计的方案如图甲、乙所示:
(2)甲同学取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞变红色,于是得出“两种物质已恰好中和”的结论.你认为他的结论是否正确?,
理由是.
(3)乙同学当观察到现象时即恰好完全反应,若此时消耗NaOH溶液2g,则污水中HCl的质量分数为.
(4)实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且要用玻璃棒不断搅拌,目的是.
(5)除去污水中的盐酸,你建议选用的原料是.
| A.NaOH | B.Ca(OH)2 | C.CuO | D.Fe |
发酵粉的主要成分中含有碳酸氢钠。某化学兴趣小组的同学对碳酸氢钠的性质进行了探究。
Ⅰ.定性探究
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH约为8,可知碳酸氢钠溶液呈性。
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、一种气体和一种常见的固体物质。
【实验1】取一定质量的碳酸氢钠放到铜片上加热,如图所示。
(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊,说明该气体是。
(3)欲通过进一步的实验探究来确定充分加热后的固体产物的成分。
【提出假设】①可能是Na2CO3
②可能是NaOH
③可能是。
【实验2】
| 实验操作 |
实验现象 |
实验结论 |
| A.将该固体溶于蒸馏水配制成溶液,取少量溶液于试 管中,滴加足量稀盐酸 |
有气体产生 |
假设(填序号)不成立 |
| B.另取少量溶液于试管中,滴加溶液 |
固体产物中有 Na2CO3 |
|
| C.取上述B步骤静置后所得上层清液,滴入少量溶液 |
无明显现象 |
假设①成立 |
【实验结论】NaHCO3受热分解的化学方程式为。
【延伸拓展】实验室有两瓶失去标签的固体药品,已知它们是碳酸钠和碳酸氢钠,你能否设计一个实验进行鉴别,请简述你的实验方案及现象和结论。。
Ⅱ.定量探究
为测定某发酵粉中碳酸氢钠的质量分数,设计了如下实验,其主要实验步骤如下:
①按下图组装仪器,取50g样品放入锥形瓶中,关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;
②关闭活塞a,打开活塞b,加入足量稀硫酸溶液,直至锥形瓶内不再产生气泡;
③关闭活塞b,打开活塞a,从导管A处缓缓鼓入一定量的空气;
④测量干燥管内碱石灰(氧化钙和氢氧化钠固体的混合物)增加的质量(见上图曲线);
⑤重复步骤③和④的操作,直至干燥管内物质质量不再增加。
(1)步骤①加入样品前还应。
(2)装置甲的作用是,装置乙的作用是;
(3)请利用相关数据计算样品中碳酸氢钠的质量分数。(写出计算过程)
(9分)松花蛋又称皮蛋。其中一种加工工艺的主要原料配方为:鸭蛋10Kg,水10Kg,生石灰1.2Kg,纯碱0.53Kg,食盐0.35Kg。加工时,将纯碱、食盐加入容器中,加沸水溶解,再慢慢加入生石灰充分反应,冷却后得到料液,再加入鸭蛋浸渍。
请回答下列问题:
(1)生石灰加入沸水中,水能持续保持沸腾,其原因是。
(2)静置后取少量的上层料液,稀释后滴加无色酚酞试液,混合液应变为色。
(3)同学们对上层料液的成分产生了兴趣,请你一起参加他们的探究活动。
【提出问题】料液中含有哪些溶质?
【交流讨论】
① 一定含有NaOH、NaCl
②甲、乙、丙三位同学对可能还会含有的溶质作出了如下猜想:
甲同学推断只有Ca(OH)2
乙同学推断只有Na2CO3
丙同学推断有Ca(OH)2、也有Na2CO3
大家讨论后一致认为丙同学的推断是错误的,理由是。(用化学方程式表示)
【探究结论】通过实验探究,同学们最终得出的结论是,甲同学的推断是正确的。请将你的探究过程填入下表。
【实验探究】
| 实验步骤 |
实验现象 |
【知识应用】料液中起主要作用的是烧碱。现行配方中,0.53Kg纯碱与足量的熟石灰作用能生成烧碱质量为千克。