(1)请用“>”、“<”或“=”填写下列空格:
①已知:Zn(s)+CuSO4(aq)==ZnSO4(aq)+Cu(s)ΔH="-216" kJ·mol-1,则E反应物 E生成物
②由A、B两金属作电极,硫酸溶液作电解质溶液,形成原电池,电流由A极经外电路流向B极,则金属活泼性A B
③镀层破损后铁的腐蚀速度比较:镀锌铁管 镀锡铁管
(2)用“增大”、“减小”或“不变”填写下列空格:
④以石墨为电极电解Na2SO4溶液时,电解过程中阳极区溶液的pH
⑤某温度下,可逆反应A(s)+ B(g) 2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
2C(g);△H<0,平衡常数为K。其它条件不变时,温度升高,平衡常数K
有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示: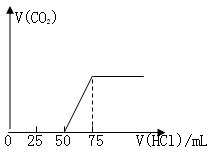
试计算:
(1)向NaOH溶液中通入CO2气体后,所得溶液
中的溶质是,其物质的量之比为。
(2)产生的CO2气体体积(标准状况)是L。
(已知:Na2CO3与HCl反应分步进行,第一步:Na2CO3+HCl=NaHCO3+NaCl;
第二步:NaHCO3+HCl=NaCl +CO2↑+H2O)
取100mL的Na2CO3和Na2SO4混合溶液,加入100 mL Ba(OH)2溶液,恰好完全反应,过滤得到白色沉淀和滤液,沉淀干燥后质量为14.51g。用过量稀盐酸处理上述沉淀,沉淀质量减少到4.66g,并有气体放出。计算:
⑴ 原混合液中Na2SO4的物质的量浓度为mol ·L-1;
⑵ 过滤出沉淀后,所得滤液的物质的量浓度为mol ·L-1(设反应前后溶液的密度均为1g·cm-3,且反应前后溶液体积变化忽略不计);
⑶在处理沉淀时产生的气体在标准状况下的体积为L。
下图所涉及的物质均为中学化学中的常见物质,其中:①C、D、E、F都为单质,其余为化合物;②C、D、E 在常温下为气体,其它物质为固体或液体;③A、I 两种化合物的焰色反应分别为紫色和黄色;④反应①、②中的一些生成物已经略去,有些反应的条件未列出,它们存在如下转化关系。
⑴ 写出有关物质的化学式:
A,D,F,I。
⑵ 指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。
⑶ 写出B与MnO2共热获得D的化学方程式____________________________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: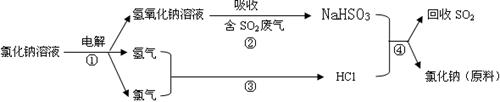
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④_____________________________________。
(1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl="2KCl" +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况。
②漂白粉的有效成分是(填化学式)。