某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。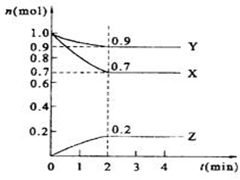
(1)X的转化率是 ;
(2)由图中所给数据进行分析,该反应的化学方程为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(4)当反应进行到第 min,该反应达到平衡。
某课外活动小组用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________,总反应的离子方程式为_________________________________。
(3)若开关K与b连接,下列说法正确的是(填序号)______________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为。
(10分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗盐酸溶液体积/mL |
19.00 |
23.00 |
23.04 |
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有_____
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用标准稀盐酸溶液润洗
D.滴定到达终点时,俯视读出滴定管读数;
E.酸式滴定管尖嘴部分有气泡,滴定后消失
F.摇动锥形瓶时有少量液体溅出瓶外
某同学在用锌与稀硫酸反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气生成的速率。请回答下列问题:
(1)上述实验中,发生的化学反应方程式有______________________________
(2)硫酸铜溶液加快氢气生成的速率的原因______________________________
(3)实验室现有Na2SO4、MgSO4、HgSO4、K2SO4等四种溶液,可与上述实验中CuSO4溶液起相似作用的是____________________
(4)要加快上述实验中气体生成的速率,还可以采取的措施有____________
现有浓度均为0.1 mol·L 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H 浓度由大到小的顺序是_____(填序号)。
浓度由大到小的顺序是_____(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH 浓度由大到小的顺序是_____(填序号)。
浓度由大到小的顺序是_____(填序号)。
(3)已知t℃时,K =1×10
=1×10 。现在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=_____。
。现在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=_____。
(8分)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l)ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________。
(2)反应②中的能量变化如图所示,则ΔH2=__________________。
(3)H2(g)的燃烧热为________________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:
_____________________________________;________________________________(写出两点即可)。