17克NH3共有_______mol原子,0.1molH2S共有 个氢原子;同质量的NH3和H2S中分子个数比为_____________。在标准状况下,35.5g氯气的体积是_______L,将其与氢气完全化合,需氢气的物质的量是________mol,将生成的气体配制成1L溶液,溶质的物质的量浓度是____________mol·L-1,将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是__________mol·L-1
(14分)化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A苯环上取代时可生成两种一取代物,化合物D能使FeCl3溶液显紫色,G能进行银镜反应。E和H常温下为气体。试回答: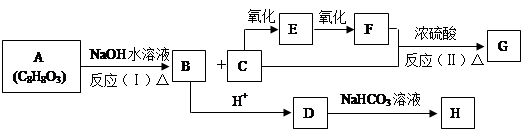
(1) 写出下列化合物的结构简式:
A:;B:;G:
(2)C中的官能团名称为
(3)反应类型:( I );(Ⅱ)。
(4) 写出D→H的化学方程式:。
(8分)有机物A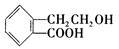 ,它可通过不同的化学反应分别制得B、C和D (下图)三种物质。
,它可通过不同的化学反应分别制得B、C和D (下图)三种物质。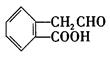
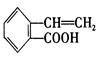
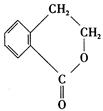
B C D
(1) A~D中互为同分异构体的是 。
(2)由A®B的化学方程式是
(3)C在一定条件下发生加聚反应的化学方程式是:
(4)写出A®C的化学方程式
(6分)(1)下列实验设计或操作合理的是__________。
a.实验室制溴苯时选用的试剂可以是溴水、苯和铁屑。
b.配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失。
c.将10滴溴乙烷加入到1mL10%的烧碱溶液中,加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
d.实验室制乙炔时,为了减慢反应速率,可用饱和食盐水代替蒸馏水。
(2)溴水是中学化学实验中常用的一种试剂,用溴水可鉴别出下列各组物质,试写出发生反应的化学方程式。
①苯酚与乙醇
②乙烯与乙烷
(8分)按官能团可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
(1) 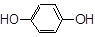 ; (2)
; (2)  ;
;
(3) 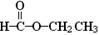 ; (4)
; (4) 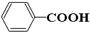
(10分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷(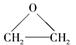 ),该反应的原子利用率为100%,反应的化学方程式为。
),该反应的原子利用率为100%,反应的化学方程式为。