硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
(14分)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系: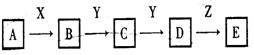
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
(1)A是_______________,Y是______________,Z是_____________。
(2)当X是强碱时,E是_______________,当X是强酸,E是____________。
(3)写出A与X反应的离子方程式:
①_____________________________________________________________________;
②______________________________________________________________________。
(12分)如图所示,已知:


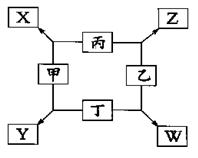
①甲、乙、丙均为前三周期元素的气体单质,丁为固体单质。
②在一定条件下甲与丙、甲与丁都按微粒个数比l:3组成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:


(1)甲是_______________________,乙是_______________________。
(2)写出X、Y的电子式
________________________________________、_________________________________。
(3)乙与丁反应生成W的化学方程式是
________________________________________________________________。
(4)甲与丙反应生成X的化学方程式是
________________________________________________________________。
(5)实验室制取X的化学方程式是
________________________________________________________________。
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。


___________________________________________________________________。
(2)此反应的还原剂是________________,它的氧化产物是_________________。
(3) 若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫
酸钾、硫酸生成外,其他的生成物还有。
(21分)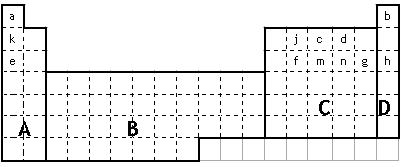
(1)在上面元素周期表中全部是金属元素的区域为。


(a)A (b)B (c)C(d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是(填名称),可以验证该结论的实
验是。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、。


(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。
A、B、C、D、E、F都是短周期元素,原子序数依次增大。
| 元素 |
有关信息 |
| A |
原子最外层电子数和电子层数相等 |
| B |
原子的最外层电子数是内层电子数的2倍 |
| C |
元素主要化合价为-2,原子半径为66pm |
| D |
与A同主族,最高价氧化物对应的水化物易溶于水 |
| E |
原子半径为104pm,所在主族序数与所在周期序数之差为3 |
| F |
单质为有色的气体 |
(1)D2C的电子式;
(2)沸点:A2CA2E(填“>”或“<”或“=”);
(3)E的非金属性比F (填“强”或“弱”),并用化学事实加以说明(用化学方程式表示);
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,是焙制糕点所用发酵粉的主要成分之一。写出甲在水溶液中与盐酸反应的离子方程式。