按要求回答以下问题:
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大。X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素。W、Q是第四周期元素,其中Q元素的核电荷数为29。W原子核外未成对电子数在同周期中最多。
①Y元素在周期表中的位置为______________ ;其轨道表示式为_________________。
②X、Y、Z元素的第一电离能由大到小的顺序为_________________(用元素符号作答),X与Z形成三原子分子的电子式为___________(用相关的化学用语作答)。
③Y的氢化物沸点_______Z的氢化物的沸点(填“ >”“<”或 “=”)。
④基态W原子的外围电子排布式为 。
⑤Q的氢化物的晶胞结构如图所示,其化学式是 。
(2)过渡元素在生活、生产和科技等方面有广泛的用途。
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,上图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为________。
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是______。(填序号)
| 元素 |
Mn |
Fe |
| 电离能 |
|
|
| (kJ·mol-1) |
|
|
| I1 |
717 |
759 |
| I2 |
1 509 |
1561 |
| I3 |
3 248 |
2 957 |
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。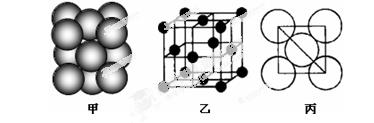
晶胞中铂(Pt)原子的配位数数为为 。
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO、CO中的一种或几种,取此溶液做下列实验:①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断: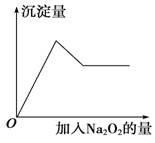
(1)溶液中一定含有的离子是______________ 。
(2)溶液中肯定不含有的离子是________________ 。
(3)可能含有的离子是____________ 。
下列实验装置图的实验操作,不能达到相应的实验目的是 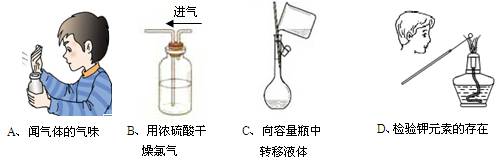
(16分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。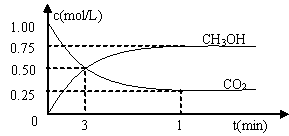
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。氢气的转化率为。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升 高温度 B.充入He(g),使体系压强增大
高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的
CH3OH(g) △H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的 同时不断充入氢气,使H2的浓度保持不变,则平衡;
同时不断充入氢气,使H2的浓度保持不变,则平衡;
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
作出此判断的理由是。
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液②AgNO3溶液③KCl溶液④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol,则E(H-Cl)=_____
(2)已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)△H=-25 KJ/mol
(g)△H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(3)如图所示的装置: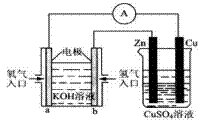
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
我国规定饮用水质量标准必须符合下列要求:
| PH |
6.5~8.5 |
| Ca2+、Mg2+总浓度 |
<0.0045mol/L |
| 细菌总数 |
<100个/mL |
某综合实践活动小组到自来水厂参观,了解到源水处理成自来水的工艺流程示意图如下: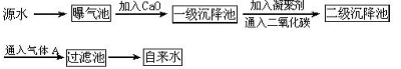
(1)源水中含有Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后发生若干个化学反应,请写出其中任意一个反应的离子方程式:_____________________________________
(2)加入絮凝剂可以除去其中的悬浮固体颗粒,该过程是____________________(填序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有物理过程,又有化学过程
(3)FeSO4·7H2O是常用的絮凝剂,加入后最终生成红褐色胶状沉淀,则这种沉淀是___________(填化学式)
(4)通入二氧化碳的目的是__________和___________。
(5)物质A的作用是_________,则A可以选择下列物质中的__________(填序号)
①ClO2②SO2③液氯④Ca(ClO2)2⑤浓硫酸