现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 。
(2) 化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)用电子式表示化合物D2C的形成过程 。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;负极反应:________________________;
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:
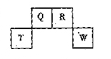
 (1)T的原子结构示意图为。
(1)T的原子结构示意图为。 (2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是。 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的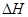 =(注:题中所涉单质均为最稳定单质)。
=(注:题中所涉单质均为最稳定单质)。
取来两份等浓度的NaOH溶液A和B,每份10ml,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,
试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 _______________mol/L
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式)___________________;其物质的量之比为_____________。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为________________ml。
(共10分)中学化学中几种常见物质的转化关系如下图所示:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F微粒直径大小的范围:__________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①写出C的酸性溶液与双氧水反应的离子方程式:________________________。
②写出鉴定C中阳离子的实验方法和现象:_______________________。
③在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_______________________________________________。
(共10分)
(1)除去NaHCO3溶液中混有的Na2CO3,相应的化学方程式_____________。
(2)除去Na2CO3固体中混有的NaHCO3,相应的化学方程式_____________。
(3)除去CO2气体中混有的HCl,相应的离子方程式___________________。
(4)除去Fe2O3中混有的Al2O3,相应的离子方程式_____________________。
(5)除去FeCl3溶液中混有的FeCl2,相应的离子方程式__________________。
(15分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为。
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液②0.01mol•L-1的NaHA溶液(常温下,其pH>7)③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为;pH由大到小的顺序为。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________(填“大于、等于、小于”或“均有可能”)。
(5)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol•L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol•L-1。