(17分)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。
①若“重整系统”发生的反应中 =6,则FexOy的化学式为______________。
=6,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的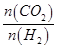 值变小
值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。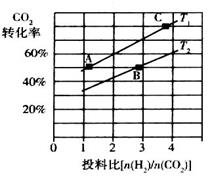
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率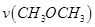 =______;KA、KB、KC三者之间的大小关系为______________。
=______;KA、KB、KC三者之间的大小关系为______________。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH4+)___c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O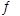 NH3·H2O+H2CO3的平衡常数K=____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
某同学设计由G(CH3CH2OH)合成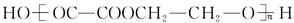 的合成路线如下:[( )内为反应类型,
的合成路线如下:[( )内为反应类型, 内为目标产物]
内为目标产物]
①写出反应类型:a________,b________;
②写出 内物质的结构简式:Ⅰ______________,Ⅱ______________。
内物质的结构简式:Ⅰ______________,Ⅱ______________。
③写出Ⅱ→Ⅲ的化学反应方程式。
④Ⅲ与Ⅵ反应合成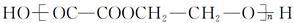 的化学方程式。
的化学方程式。
从中草药茵陈蒿中可提取出一种利胆有效成分——对羟基苯乙酮,其结构简式为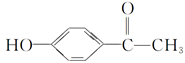 ,这是一种值得进一步研究应用的药物。
,这是一种值得进一步研究应用的药物。
(1)推测该药物不具有的化学性质是______。
| A.能跟氢氧化钾反应 |
| B.能跟浓溴水反应 |
| C.能跟碳酸氢钠反应 |
| D.在催化剂存在时能被还原成含醇羟基的物质 |
(2)写出上述(1)中能发生反应的所有化学方程式:。
分子的性质是由分子的结构决定的,通过对下列分子结构的观察来推测它的性质:
(1)此有机物中含有的官能团(填名称)
(2)苯基部分可发生________反应和__________反应(填反应类型)。
(3)—CH===CH2部分可发生__________反应和_______反应等,检验此官能团所用试剂为。
(4)写出此有机物形成的高分子化合物的结构简式:______________。
(5)试判断此有机物的—C(CH2Cl)3部分______(填“能”或“不能”)发生消去反应。
A~G是几种烃分子的球棍模型(如图),据此回答下列问题: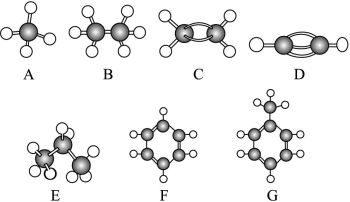
(1)常温下含碳量最高的气态烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)一卤代物种类最多的是(填对应字母)__________;
(4)写出C发生加聚反应的化学方程式:______________________;
(5)写出F发生溴代反应的化学方程式:______________________。
(1)按系统命名法填写下列有机物的名称: 的名称是____________________。
的名称是____________________。
(2)2,6-二甲基-4-乙基辛烷的结构简式是______________,1 mol该烃完全燃烧需消耗氧气________mol。