环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
(1)连续自动监测氮氧化物(NOx)的仪器——动态库仑仪已获得实际应用。它的工作原理如下图所示。NiO电极上NO发生的电极反应式为 。
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术。压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)  2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)  N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H3= (用△H1和△H2表示)。
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①在NO2与CH4反应时,可提高NO2转化率的措施有 (填编号)。
A.增加催化剂的表面积
B.改用高效催化剂
C.降低温度
D.增大压强
E.分离出H2O(g)
F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容 积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图。
(4)SNCR是一种新型的烟气脱氮环保技术。在有氧条件下,其脱氮原理是:
NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示。图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条): 。
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。
【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: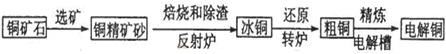
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是、,反射炉内生成炉渣的主要成分是;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是、;
(3)粗铜的电解精炼如图所示。
在粗铜的电解过程中,粗铜板是图中电极(填图中的字母);在电极d上发生的电极反应为;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为。
【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是,属区元素,它的最外层电子的电子排布图为。
(2)XZ2分子的立体结构是,YZ2分子中Y的杂化轨道类型为,相同条件下两者在水中的溶解度较大的是(写分子式),理由是。
(3)含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
、I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为,该反应的Q0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)=。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生(填“可能”或“不可能”),理由是。