(1)已知:M(g)+N(g) P(g)+W(g)ΔH>0,请回答下列问题:
P(g)+W(g)ΔH>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为 。
A、加入一定量M
B、加入一定量N
C、反应温度升高
D、缩小容器体积
E、加入某物质作催化剂
F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= 。
(2)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
③ a.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1277 kJ·mol-1
b.2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
c.C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
d.H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=________。
( 1)在上面元素周期表中画出金属元素与非金属元素的分界线。
1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的族。
(3)甲、乙两种元素,甲元素原子核外第三电子层上有7个电子,乙元素的焰色反应呈黄色。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲元素与硫元素相比较,非金属性较强的是(填名称),写出可以验证该结论的一个化学方程式:。
Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应: N2(g)+3H2(g)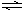 2NH3(g); △H<0
2NH3(g); △H<0
(1)工业生产中,该反应通常在高压下进行反应,做出此选择的理由是:
①;
② 。
(2)开始时放入1mol N2和3mol H2,到达平衡后,生成amol NH3,若开始时放入χmol N2、3mol H2和y mol NH3,到达平衡后,NH3的物质的量为 3amol,则x= mol,y= mol。
Ⅱ、若该容器恒压、绝热(与外界不发生热交换),在一个与(2)反应前起始条件完全相同的容器中发生上述反应
(3)若开始时放入1mol N2和3mol H2,到达平衡后,生成b mol NH3,将b与(2)小题中的a进行比较(选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
Ⅲ、某研究性学习小组为探究利用电化学原理合成氨,设计如图所示的装置,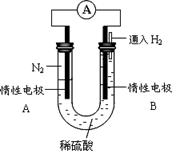
(4)电极B为极
(5)电极A发生的电极反应式为
(6)该电池工作一段时间后,电解质溶液pH
(填增大、减小或不变)
(共10分)化学式为C11H12O4的芳香族化合物A、B互为同分异构体,A和D都能发生银镜反应,E的一溴取代物只有两种, A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。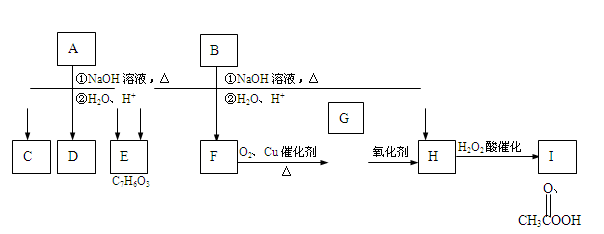
(1)A有2种可能结构,写出其结构简式。
(2)在B、C、D、F、G、I化合物中,互为同系物的是。
(3)写出D与F在加热和浓H2SO4催化作用下发生反应的化学方程式
,指出反应类型。
(4)除银镜反应外至少选用其它两种实验方法证明D具有还原性,请按要求填写下表:
| 所选试剂 |
观察到的实验现象 |
|
| 方法1 |
||
| 方法2 |
(10分)短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,1 molF中含有10mol原子。
请回答下列问题:
(1)C的气态氢化物的电子式为,A在周期表中的位置
(2)化合物E2D2中阴阳离子个数比为,F含有的化学键类型为
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式并用单线桥表示电子转移的方向和数目
(5)将A2、D2分别充人多孔性石墨电极,将电极插入EDA的水溶液中构成原电池,负极的电极反应为;一段时间后EDA的浓度将(填“变大”、“变小”、“不变”或“无法确定”)。
A、B、C、D、E、F、G、H、IJ分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),
且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_______周期、第_______族;
(2)写出反应①的化学方程式____________________;
(3)写出反应④的离子方程式____________________;
(4)写出反应③的电极方程式:
阳极:____________________阴极:______________________
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)