实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为 。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是 。
A、溶解后的溶液未冷至室温就转入容量瓶中;
B、洗涤烧杯和玻棒的溶液未转入容量瓶中;
C、定容时眼睛俯视刻度线;
D、定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: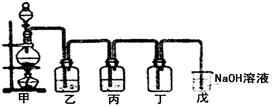
 ①写出甲中发生反应的离子方程式:________
①写出甲中发生反应的离子方程式:________
②乙中盛的试剂是 ;作用是 。丙中盛的试剂是 。
(2)如果将过量二氧化锰与20 mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积
为 mL,而实际值明显少于理论值,其主要原因有:
① ;② 。
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变 色,其离子方程式是 ,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显 色,这种操作叫做 。
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是 。
(5)用滴管将新制饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,褪色的原因可能有两种(用简要文字说明)①是由于 ;②是由于 。简述怎样用实验证明红色褪去的原因是①或者② 。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: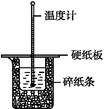
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”)。所求中和热(填“相等”或“不相等”),简述理由:。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会,用50 mL 0.50 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会(均填“偏大”“偏小”或“无影响”)。
碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的、以化合态形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)步骤④除了加入过量Cl2,下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是____________________________。
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
(6)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。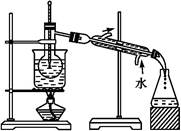
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
(2)实验结论: 。
如图所示,分馏装置中,如果有错误请指出并加以改正: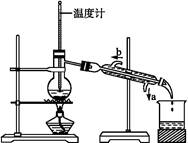
(1) _____________________________,
(2) _____________________________,
(3) _____________________________。
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其化学方程式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。