废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下: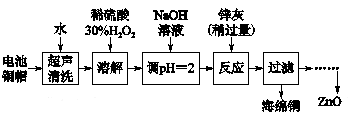
(1)①铜帽溶解时加入H2O2的目的是______________________ (用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是______。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O32-+I2===2I-+S4O62-
①滴定选用的指示剂为________,滴定终点观察到的现象_____________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的正确实验步骤依次为:
①过滤;
②调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
③过滤、洗涤、干燥;
④调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
⑤向滤液中加入适量30% H2O2,使其充分反应;
⑥900 ℃煅烧;
(4)Zn(OH)2的溶度积常数为1.2×10-17(mol•L-1)3,当Zn2+沉淀完全时,此时溶液中Zn2+的浓度为
能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。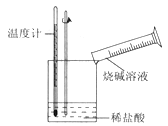
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是___________________,正极的电极反应式是______________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。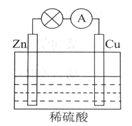
葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式
C6H12O6(葡萄糖) 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗b. 分液漏斗c. 长颈漏斗
“低钠盐”可以控制钠的摄入量从而防治高血压等疾病.制备“低钠盐”在食盐中用NaCl中按照配方比例添加食用KCl.国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2).
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%.该样品a的水溶液中,含量最多的离子是 (填离子符号).
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水
| 实验操作 |
预期现象及结论 |
| 步骤1:取少量样品b于烧杯中, |
样品溶解,形成无色溶液. |
| 步骤1:取少量步骤1形成的溶液于试管中,在滴加少量NaOH溶液,振荡 |
,说明样品b中添加了镁盐 |
| 步骤3: |
|
实验室常用下列装置制取气体,请你根据所学知识回答下列问题。
(1)仪器a的名称是 。
(2)实验室制取氧气时,选用的收集装置是 (填字母序号)。
若改用下图装置收集氧气,则气体应从 进(填“a”或“b”)。
(3)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为______________________________;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体。
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色。于是排除了猜想A,你认为排除猜想A的理由是_____________。
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验。请你帮他完成实验,填写以下表格:
| 实验步骤 |
实验现象 |
实验结论 |
| 气体中有HCl |
【查阅资料】
碳酸钠溶液中通入二氧化碳发生反应: Na2CO3 + CO2 + H2O = 2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为 (填字母)。
工业烟气通常含有二氧化硫,在排放前需经脱硫处理。右下图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略)。
请回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅱ所属的基本反应类型是 ,CaSO3中Ca、S、O元素的质量比是 。
(3)已知原料NaOH的价格为2.9元/kg、Ca(OH)2的价格为0.36元/kg。两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是 。