在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图: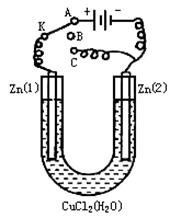
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ __;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
浓度均为0.1mol·L-1的8种溶液:①HNO3②H2SO4③HCOOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl,其溶液的pH由小到大的顺序是(填写编号)______________________。
已知NaHCO3溶液呈弱碱性,则:
(1)溶液中各离子浓度大小顺序为_________________。
(2)由物料守恒可得c(Na+)=______________________。
(3)由电荷守恒可得c(Na+)+_________=________________。
Na2SO3和NaClO两种钠盐分别溶于水后,溶液的pH均大于7,露置于空气中相当一段时间后(不考虑水分挥发)溶液pH都近似为7。这两种溶液呈碱性的原因分别是:_______________________、________________________(用离子方程式表示)。久置呈中性的原因是_____________________________________________________________________。
某盐的化学式XmYn为最简结构(m≠n),将一定量的盐溶于足量水时:
(1)若测得溶液的pH为5,则该盐与水反应的离子方程式可能为:__________________。
(2)若测得该盐溶液的pH为9,则该盐与水反应的离子方程式可能为:_______________。
(3)若X、Y为同周期的短周期元素,XmYn溶于水时,有白色沉淀产生,又有无色气体放出,则XmYn溶于水的化学方程式为:______________________________。
已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c( )>c(H+)>c(OH-)②c(Cl-)>c(
)>c(H+)>c(OH-)②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶液是_______________,上述四种离子的浓度的大小顺序为_______________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_______________;若上述关系中④是正确的,则溶液中的溶质是_______________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好成中性,则混合前c(HCl)_________c(NH3·H2O)(填“大小”“小于”或“等于”)。