通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是(写出计算过程) 。
(2)X与金属钠反应放出氢气,反应的化学方程式是 。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 。
(4)X与酸性高锰酸钾溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W。若184 g X和120 g Z反应能生成106 g W,计算该反应的产率(实际产量与理论产量之比) 。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
 阴离子 阴离子Ksp  阳离子 |
CO32- |
F- |
OH- |
| Ca2+ |
5.0×10-9 |
1.5×10-10 |
4.7×10-6 |
| Mg2+ |
3.8×10-6 |
7.4×10-11 |
5.6×10-12 |
| Mn2+ |
2.2×10-11 |
5.3×10-3 |
2.1×10-13 |
| Zn2+ |
1.2×10-10 |
3.0×10-2 |
6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+ H2O(g)  CO(g)+ H2(g);
CO(g)+ H2(g);
②用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。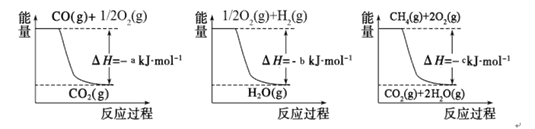
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=3mol/Lb.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
α,β不饱和化合物在有机合成中有着广泛的用途。反应①是合成α,β不饱和化合物的常见的方法。
反应①: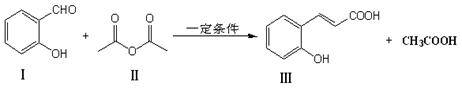
(1)化合物Ⅲ的分子中含氧官能团的名称为 ,1mol化合物Ⅰ完全燃烧消耗 molO2。
(2)下列说法中不正确的是 。
| A.反应①属于取代反应 |
| B.1mol化合物Ⅰ、Ⅲ与氢气完全加成均需要4mol氢气 |
| C.化合物Ⅰ、Ⅲ均能与NaHCO3溶液反应 |
| D.化合物Ⅲ与Br2既能发生取代反应,也能发生加成反应 |
(3)化合物Ⅳ可以通过化合物Ⅲ在一定条件下发生分子内的酯化得到;请写出该反应的化学方程式(注明必要的条件) 。
(4)符合下列条件的化合物Ⅳ的同分异构体有____种;
①遇氯化铁溶液显紫色;
②能发生银镜反应;
③苯环上只有三个取代基
(5)化合物 是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
(15分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g-1
N2(g) + 2O2(g) = 2NO2(g) △H=+133kJ·mol-1
H2O(g) =H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a.混合气体的平均式量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。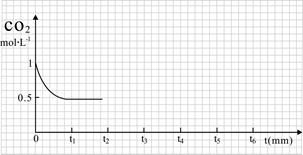
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 |
CO2(mol) |
H2(mol) |
CH3OH(mol) |
H2O(mol) |
|
| 反应I恒温恒容 |
0 min |
2 |
6[ |
0 |
0 |
| 10min |
4.5 |
||||
| 20min |
1 |
||||
| 30min |
1 |
||||
| 反应II 绝热恒容 |
0 min |
0 |
0 |
2 |
2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
(18分)甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答下列问题: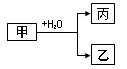
I.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(1)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为 (用具体的微粒表示)。
(2)若乙是O2,则甲的一种重要用途是 ;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 。
Ⅱ.一种灰白色固体粉末X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:l。在一定条件下X可发生如下图转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为混合气体,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。请回答下列问题: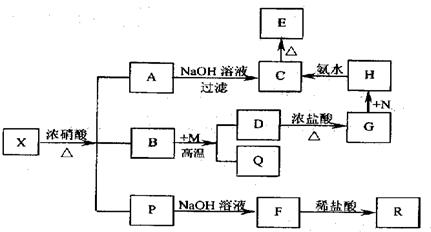
(1)X的化学式为______________;R的电子式为_________________。
(2)写出气体P的组成 。
(3)写出D→G的离子反应方程式 。
(4)M与钛构成的合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、M3+溶液中加入M至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+==2Ti3+ (紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O ="=" TiO2+ (无色)+Fe2++2H+
③ 。
请写出③可能的反应方程式 。
(5)人们对X的结构研究后发现其金属元素有0价、+2价两种化合价,写出X与稀硫酸反应的化学方程式 。
(6)合硫酸M是一种常见的净水剂,化学式为:[M2(OH)n (SO4)3-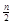 ]m (n>2,m≤10),其制备可由硫酸M经水解后再聚合得到,其中聚合反应的原理为m[M2(OH)n(SO4)3-
]m (n>2,m≤10),其制备可由硫酸M经水解后再聚合得到,其中聚合反应的原理为m[M2(OH)n(SO4)3-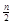 ]
]  [M2(OH)n(SO4)3-
[M2(OH)n(SO4)3-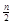 ]m,则写出硫酸M水解的化学方程式为 。
]m,则写出硫酸M水解的化学方程式为 。