(12分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol。
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式:____________________。该电池总反应式:________________________。
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到0.32 g O2,中和电解生成的酸需0.4 mol·L-1 NaOH溶液 mL。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。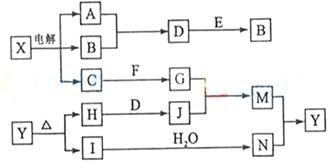
请回答下列问题:
(1)B中所含元素位于周期表中周期族
(2)A在B中燃烧的现象是。
(3)D+E→B的反应中,n(被氧化的物质):n(被还原的物质)=。
(4)G+J→M的离子方程式是。
(5) 受热分解的化学方程式是。
受热分解的化学方程式是。
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是。
(2)某实验小组利用右图装置验证铁与水蒸气的反应。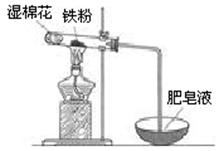
①湿棉花的作用是,试管中反应的化学方程式是。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
①铁与浓硫酸反应的化学方程式是。
②气体中混有CO2的原因是(用化学方程式表示)。
③将672 mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2 + Br2 + 2H2O =" 2HBr" + H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是。
⑴课本上叙述:“碳、硅、锗、锡的+4价化合物是稳定的.而铅的+2价化合物是稳定的。” 据此判断:锡的+2价化合物(如SnCl2)应具有较强的(填“氧化”或“还原”.下同)性,铅的+4价化合物应具有较强的性。PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的化学方程式为。
(2)我国古代炼丹中经常使用到红丹,俗称铅丹。在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3 PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是,此铅丹中铅的化合价是。由此反应可推测PbO是(填“酸”或“碱”)性氧化物。
PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是,此铅丹中铅的化合价是。由此反应可推测PbO是(填“酸”或“碱”)性氧化物。
⑶砷酸钠在酸性条件下跟碘化钾溶液反应生成亚砷酸钠(Na3AsO3)、碘单质和水的离子反应方程式是,上述反应中电子转移数目是。
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。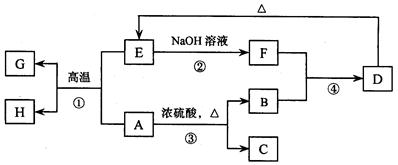
请填空:
(1)H的名称是。
(2)E的两种用途是、。
(3)反应③的化学方程式是。
(4)反应④的离子方程式是。
(1)下列有机物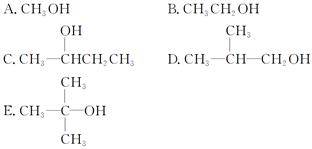
其中能被氧化成醛的有______________,不能被催化氧化的有____________,可发生
消去反应的有____________
(2)有机物A为茉莉香型香料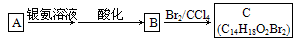
①A分子中含氧官能团的名称是____________.
②C的分子结构可表示为(其中R和R′代表不同的烃基):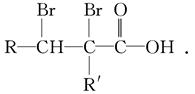
A的化学式是__________,A可以发生的反应是________________(填字母序号).
a.还原反应 b.加成反应 c.氧化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________________.
(4)A分子结构中只有一个甲基,A的结构简式是_____________________________
________________________________________________________________________.