在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x+ +xR—H→Rx[CrCln(H2O)6-n]x++xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.001 5 mol[CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.120 0 mol·L-1 NaOH 溶液25.00 mL,该配离子的化学式为_______。
制取碘盐的流程如下:
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是 ▲。
(2)过滤时,用到的玻璃仪器有: ▲、 ▲、 ▲。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: ▲mg/Kg(保留一位小数),是否是合格产品 ▲(填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是 ▲。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: ▲或 ▲。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图18所示:
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.N2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① ;
② 。
。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是 。
。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答: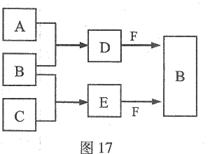
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。(已知甲醇的燃烧热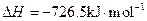 ,氢气的燃烧热
,氢气的燃烧热 )
)
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
已知:①RCH=CH2+CO+H2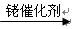

②烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物c的核磁共振氢谱显示其分子中含有5种氢原子,且其峰面积之比为3:2:2:2:1;DBP分子中苯环上的一溴取代物只有两种。
(1)A的结构简式是 。
。
(2)B含有的官能团名称是 。
(3)有机物C和D反应生成DBP的化学方程式是 。
(4)下列说法正确的是(选填序号字母) 。
a.A能发生聚合反应、加成反应和氧化反应
b.和C互为同分异构体,且含有相同官能团的有机物有2种
c.邻二甲苯能氧化生成D说明有机物分子中基团之间存在相互影响
d.1 mol DBP可与含2 mol NaOH的溶液完全反应
(5)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
①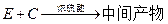 ②
②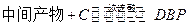
工业生产中在第②步中使用油水分离器将反应过程中生成的水不断从反应体系中分离除去,其目的是 。
(6)工业上生产有机物E的反应如下: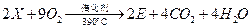
芳香烃X的一溴取代物只有两种,X的的结构简式是 。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 和 (填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质为记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴人稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:X为 。
A.SO3- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液中所有离子的浓度由大到小的顺序为 (用离子符号表示)。
(4)将0.02 mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (保留一位小数)。
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为: 。
(6)利用上述已经确定的物质,可以检验出D,E中的阳离子。请简述实验操作步骤、现象及结论 。