无水AICl3可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
(1)在焙烧炉中发生反应:①Fe2O3(S) +3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g).
2Fe(s)+3CO2(g).
则反应②的平衡常数的表达式为K= 。
(2)Al2O3、Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移 mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为: 。
(3)升华器中发生反应的化学方程式为 。
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AICl3,此反应必须在氯化氢的气流中加热,其原因是 。
已知SOCl2为无色液体且极易与水反应生成HC1和SO2,AlC13·6H2O与SOCl2混合加热可制取无水AlCl3,写出该反应的化学方程式: 。
(18分)(1)原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列
问题:
①具有(n-1)d10ns2电子构型的元素位于周期表中________区和________族。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电
子数为__________________。
(2)等电子原理——原子总数相同、价电子总数相同的粒子具有相似的化学键特征,它们的
许多性质是相近的。写出两种由多个原子组成的含有与N 电子数相同的粒子的化学式
电子数相同的粒子的化学式
__________、____________。
(3)氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。氯化亚砜分子的
几何构型是______________;中心原子采取________杂化方式。
(4)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危
害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ 4种类型,苏丹红Ⅰ号的分子结构如图1所示。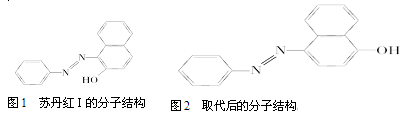
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,
则其在水中的溶解度会______(填“增大”或“减小”),原因是____________________。
(10分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:B、_________,C、________,D、________,E、________;
(2)写出A、B、C形成的化合物M的化学式;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;
(4)D单质与M的水溶液反应的离子方程式:。
(14分)
Ⅰ(1)写出表示含有8个质子、10个中子的原子的化学符号。
(2)元素周期表中,所含元素超过18种的周期是。
Ⅱ有:①168O、178O、188O ②H2O、D2O ③石墨、金刚石 ④H、D、T 四组微粒或物质,回答下列问题(填序号):
(1)互为同位素的是___________; (2)互为同素异形体的是_______________;
(3)由①和④中微粒能结合成含三个原子的化合物,其中相对分子质量最大的是________(填化学式)。
III(1)用电子式表示Na2S的形成过程:。
(2)用电子式表示H2O的形成过程:。
(12分)过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: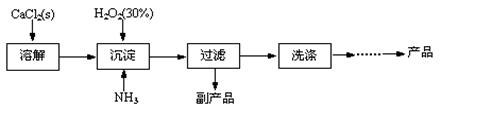
(1)用上述方法制取CaO2·8H2O的化学方程式是。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①;②。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol/LKMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为。
(4)根据表1数据
表1. KMnO4标准溶液滴定数据
| 滴定次数 |
样品的质量/g |
KMnO4溶液的体积/mL |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
0.3000 |
1.02 |
24.04 |
| 2 |
0.3000 |
2.00 |
25.03 |
| 3 |
0.3000 |
0.20 |
23.24 |
计算产品中CaO2·8H2O的质量分数(写出计算过程):
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中的燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是;
(2)由以上五种元素两两组合所形成的常见化合物中,有一种气体物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH7(填“大于”、“小于”或“等于”)。原因是(用离子方程式表示)
(4)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型原电池,放电时溶液中H+移向(填“正”或“负”)极。