化学实验技能是学习化学和进行探究活动的基础和保证.某化学兴趣小组进行了一些实验,主要操作过程如图所示:

请回答下列问题:
(1)实验甲中配制氢氧化钠溶液时,氢氧化钠固体用托盘天平称量时应该放在________内,所需的硫酸铜溶液在配制前应先将硫酸铜晶体研碎,其实验目的是_______________________,甲烧杯内的实验现象是 .
(2)实验乙、丙中均使用到了玻璃棒.玻璃棒属于 (选填“金属”、“无机非金属”、“合成”或“复合”)材料.
(3)下列实验中要使用玻璃棒的是 (填序号).
| A.稀释浓硫酸 | B.硫在氧气中燃烧 |
| C.用PH试纸测肥皂水的PH | D.实验室制取二氧化碳 |
(4)实验丁中将氧化铜和木炭粉混合物加入试管中的正确操作是_________
(5)丁实验结束时先进行的操作是__________(填序号)
①停止加热 ②从石灰水中移出导管
(12分)单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。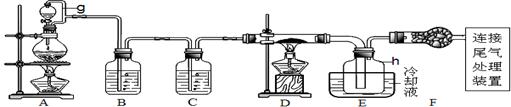
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
(1)下列各种情况,在其中Fe片腐蚀由快到慢的顺序是 .
(2)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中负极反应式为 ;正极反应式为 .
(本题共12分)下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。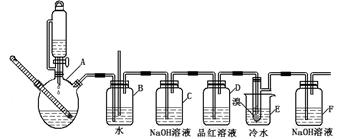
有关数据列表如下:
请完成下列填空:
41.A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:__________________。
42.气体发生装置使用连通滴液漏斗的原因_____________________________________。
43.请写出C装置中的离子反应方程式_______________________________________。
44.装置D中品红溶液的作用是__________________________________;
45.反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是____________________________________。
46.学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是______________。
47.有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是__________________________。
(13分)某小组对Cu与浓HNO3的反应进行研究。记录如下:
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是
、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2- Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验: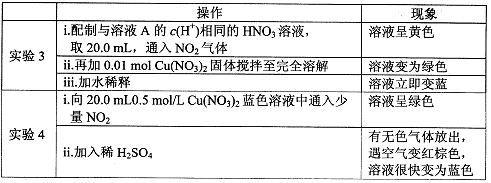
①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。