【2015上海化学】(本题共12分)
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2⇌CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
(2)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 。温度偏低也不利于碳化反应,原因是 。
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10 min到13 min之内钙离子的反 应速率为 。15 min之后钙离子浓度增大,原因是 (用化学方程式表示)。

(4)Mg原子核外电子排布式为 ;Ca原子最外层电子的能量 Mg原子最外层电子的能量(选填“低于”、“高于”或“等于”)。
工业上处理含铬(主要成分是HCrO4-)污水并制备磁性铁铬氧体工艺流程如下:
(1)还原过程中HCrO4-转化为Cr3+ 的离子方程式为 ;
(2)当沉淀池中c(Fe2+):c(Fe3+)=2:1时,能生成铁铬氧体。通入压缩空气是形成铁铬氧体的必要条件之一,通入压缩空气的目的是 、 。在加NaOH溶液之前通入的空气量不宜过多,若过多必须向沉淀池中增补的物质可能为: 。(填字母)
| A.FeSO4 | B.Cu | C.H2O2 | D.Fe |
(3)已知三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH 的变化如右图,为尽可能除去铬元素实现清液达标排放,沉淀池中pH要控制在 ;若pH过高,溶液中残留铬量增大,其原因为 。
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)Cu+基态的电子排布式可表示为____________。
(2)1mol甲醛(HCHO)中含有的σ键数目为______________。
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为______________。这两种不同化合物的化学式分别为________________、_______________。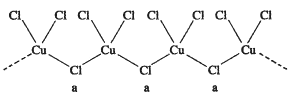
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,①反应的离子方程式为_________;②[Cu(NH3)4]2+中存在的化学键类型有_______(填序号)。
| A.配位键 | B.离子键 | C.极性共价键 | D.非极性共价键 |
(5)金属铍与氯气也可以形成化合物,在气态二氯化铍中有单体BeCl2和二聚体(BeCl2)2;在晶体中变形成多聚体(BeCl2)n。试画出各种存在形式的结构式,并指出对应Be原子的杂化轨道类型。
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
已知下列物质在20 ℃下的Ksp如下,试回答下列问题
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是__________________;
(2)向浓度均为0.1mol/L的KCl和KBr混合溶液中加入足量AgNO3溶液,当两种沉淀共存时,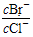 =________________。
=________________。
(3)向AgBr的饱和溶液中加入Na2S溶液,反应的离子方程式是______________。该反应的平衡常数表达式是:_____________。
(4)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂______________。
| A.KBr | B.KI | C.K2S | D.K2CrO4 |
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下: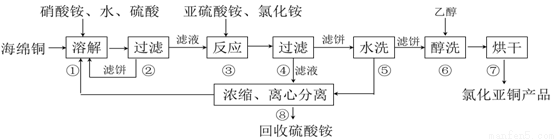
回答下列问题:
(1)步骤①溶解温度应控制在60~70度,原因是_____________,加入硝酸铵的作用是_____________。
(2)写出步骤③中主要反应的离子方程式_______________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)="2NO(g)" ΔH=+180.5 kJ·mol-1
②2C(s)+O2(g)="2CO(g)" ΔH=-221.0 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则该反应的热化学方程式为:________________。
(2)NO2与SO2混合可发生反应:NO2+SO2 SO3+NO。
SO3+NO。
I.在100℃1molNO2与1molSO2的混合气体置于绝热恒容密闭容器中发生上述反应,
①正反应速率随时间变化的趋势如图所示,则下列说法正确的是___________(填字母)。
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量高于生成物的总能量 |
| D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段 |
E.当反应达到平衡时,继续充入1molNO2,则NO的体积分数变小
②判断此反应达到平衡的标志是_______
A体系的压强不再发生变化
B混合气体的密度不变
C混合气体的平均相对分子质量不变
D各组分的物质的量浓度不再改变
E体系的温度不再发生变化
F v(NO2)正=v(NO)逆
II.在常温时,维持体系总压强P恒定,体积为V升的1molNO2与1molSO2的混合气体于密闭容器发生上述反应,已知NO2的平衡转化率为α,则在该温度下反应的平衡常数K=_____________(用α,V等符号表示)。
(3)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。试回答下列问题:
①该燃料电池正极电极反应式为:______________。
②25℃时,某学生想用该燃料电池电解一定量的硫酸钠饱和溶液中进行电解,当电路中有amol电子转移时,溶液中析出mgNa2SO4·10H2O晶体。若温度不变,在剩余溶液中溶质的质量分数为__________,消耗掉的丁烷在标准状况下的体积为______________。