X、Y、Z、M四种短周期元素的原子半径依次减小。甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的2/3;乙是日常生活的基础能源,其中含元素Y的质量分数为75%;丙是具有强氧化性的弱酸。丁为丙的钠盐,常用于漂白或消毒。戊与甲的组成元素相同,其分子具有18电子。请按要求回答下列问题:
(1)元素X、Y的最高价氧化物的水化物的酸性由强到弱为(填化学式)_____ __;丁的电子式为___________;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)_______、______。
(2)元素E、F与X同周期。
①常温下E的单质与甲反应缓慢,加热至沸反应迅速,滴加酚酞试液,溶液变红色;此反应的化学方程式为 。
②F的单质粉末加油漆后即得“银粉漆”,在汽车漆家族中有重要地位。写出保存“银粉”时的注意事项:_____________、_____________等。
(3)向盛有一定浓度戊溶液的烧杯中逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中可依次观察到的现象:
a.浅绿色溶液变成黄色
b.有少量气泡产生,片刻后反应变得更剧烈,并放出较多热量
c.继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀
①现象a中反应的离子方程式:____________________;
②现象b中反应剧烈的化学方程式:_____________________;
③解释现象c:_________________________。
请根据题意回答下列 问题:
问题:
Ⅰ、当甲烷的四个氢被甲基替换后,得到新戊烷,新戊烷的所有氢原子再被甲基替换得到新的烷烃,……
(1)请写出甲基电子式。
(2)新戊烷的三氯代物有种同分异构体。
(3)试写出甲烷按上述方法连续进行三次甲基替换操作后所得烷烃的分子式
Ⅱ、分子式为C7H16的烃为手性分子,在核磁共振氢谱中有6个吸收峰,则该烃分子的结构简式为_______;其系统命名法的名称为______。
Ⅲ、现有CH4、C2H2、C3H4、C3H8 四种气态烃,回答下列问题(填分子式):
(1)当这四种气态烃质量相同时,分别在氧气中完全燃烧,消耗O2的量最多的是_____;生成水的量最少的是_____。
(2)在120℃,101Kp时,取上述气态烃中的某一种烃1L和3L过量的氧气在密闭容器中完全燃烧,恢复到原来的状况,测得燃烧后气体的总体积仍是4L,则该烃是____________。
水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
( 2)已知2H2O
2)已知2H2O  H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+ + OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
①在冰晶体中每一个水分子内含有两个氢键;
②水分子是由极性键构成的极性分子;
③水在化学反应中可以作氧化剂,也可以 作还原剂;
作还原剂;
④水分子中既含σ键,又含有π键;
⑤纯水呈中性,所以在任何条件下纯水的PH 均为7;
均为7;
⑥水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定 性:沸点:
性:沸点:
水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为。(原子量Ca:40,O:16,H:1)
在800℃时,2L密闭容器内,2NO(g)+O2(g) 2NO2(g)反应体系中,n(NO)随时间的变化如表:
2NO2(g)反应体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。
已知: >
>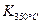 ,则该反应是热反应。
,则该反应是热反应。
(2)上图中表示NO2的变化的曲线是;
用O2表示从0~2 s内该反应的平均速率v=。
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2 )b.容器内压强保持不变
)b.容器内压强保持不变
c.v逆(NO)=2v正(O2 )d.容器内密度保持不变
)d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离除NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂
已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ∕mol
②C(S)+O2(g)=CO2(g)△H=-393.5kJ∕mol
③2C(S)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ∕mol
请写出H2燃烧热的热化学方程式 。
。