有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
① Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 ;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为
组合1: ;组合2: ;……(用化学式表示)
某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应:判断滴定终点的现象是。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”、“偏小”或“无影响’')。
(3)按正确操作测得有关数据记录如下: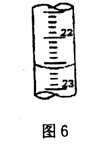
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
20.38 |
| 第二次 |
20.00 |
4.00 |
24.20 |
| 第三次 |
20.00 |
2.38 |
a |
①a的读数如图6所示,则a= ;
②烧碱样品的纯度为% 。
某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
实验1:如图所示连接装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30 s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
实验2:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
| 序号 |
操作 |
现象 |
| ① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
阅读资料:常见铜的化合物颜色如下:
| 物质 |
颜色 |
物质 |
颜色 |
| 氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜(不稳定) |
橙黄色 |
| 碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
| 氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
请回答下列问题:
(1)铜的常见正化合价为________、________,最终试管底部橙黄色沉淀的化学式________________.
(2)阴极上发生的反应为________________;阳极上发生的反应为________________.
(3)写出实验2中①、②的离子方程式:
①____________________________________,②______________________________.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 .
(3)实验①和②的目的是__________________________________________.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图.
分析上图能够得出的实验结论是.
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。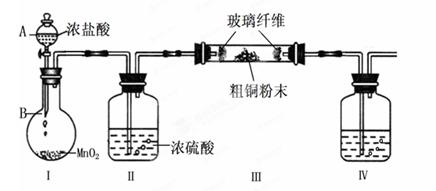 ③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
④装置Ⅳ中盛装的试剂是,其作用是。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq) CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
① 上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
②现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
a.b.。
海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:(已知C12+2KI=2KCl+I2)
(1)指出提取碘的过程中有关的实验操作名称:①,③。
(2)提取碘的过程中,可供选择的有机试剂是()
A.苯、酒精 B.CCl4、苯 C.汽油、酒精
(3)为使海带灰中碘离子转化为碘的有机溶液,实验室里的烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,仍缺少的玻璃仪器
_________________________。