(1).250C时,①0.1mol·L-1的盐酸②0.2mol·L-1的硫酸 ③0.1mol·L-1的醋酸④0.1mol·L-1的氨水⑤0.1mol·L-1的NaOH溶液⑥0.1mol·L-1的Ba(OH)2溶液,其pH由小到大的顺序是_____(填序号)
(2)下列物质中①NaCl ②BaSO4 ③H2SO4 ④KOH ⑤石墨⑥H2CO3 ⑦CH3COOH ⑧NH3·H2O ⑨蔗糖⑩酒精⑪SO2 ⑫Cu ⑬Cl2 ⑭CO2。其中属于强电解质的有_________;其中属于弱电解质的有__________;其中属于非电解质的有________。
(3)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后, ____
____ (填“>”“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积VA_______VB.(填“>”“=”或“<”)。
(填“>”“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积VA_______VB.(填“>”“=”或“<”)。
(4)250C时,若10体积某强碱溶液与1体积的某强酸溶液混合后,溶液的pH=7,则混合前,该强碱溶液的pH与强酸溶液pH之间应满足的关系是__________。
氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有: 、 (各举1例),由此可推知N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、
Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。
[Co (N3)(NH3)5]SO4中钴的配位数为 ,CN—中C原子的杂化类型是 。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,则该异构体是(填“极性”、“非极性”)分子。
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是(选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
____________。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。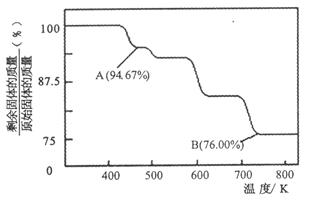
①A 点时剩余固体的成分是_________(填化学式)。
②从开始加热到 750K 时总反应方程式为_______________________。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为mol·L-1。
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)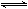 N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K=(保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1
③H2O(g)=H2O(l)△H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为。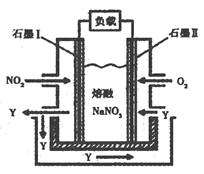
(16分)止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下: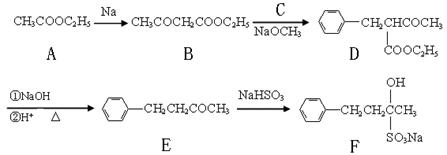
(1)写出B中含有的官能团名称:。
(2)已知B→D反应属于取代反应,写出C(C属于氯代烃)的结构简式:。
(3)写出E→F的反应类型:。
(4)满足下列条件的E的同分异构体有种。
①苯环上有两个邻位取代基;②能与FeCl3溶液发生显色反应;
③除苯环外不含其它的环状结构。
(5)写出A→B的反应方程式:。
(6)A→F六种物质中含有手性碳原子的是:(填物质代号)。
(7)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮。合成过程中无机试剂任选。
提示:合成路线流程图示例如下:
(15分)用煤化工产品C8H10合成高分子材料I的路线如下:
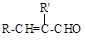 已知:(1)B、C、D都能发生银镜反应,且苯环上的一卤代物有两种。H含有三个六元环。
已知:(1)B、C、D都能发生银镜反应,且苯环上的一卤代物有两种。H含有三个六元环。
(2)RCHO+R'CH2CHO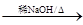 + H2O
+ H2O
根据题意完成下列填空:
(1)A的名称是; D中含有官能团的名称。
(2)D→E的反应类型是;
(3)C和H的结构简式分别为、。
(4)E→F的化学方程式是。
(5)G→I的化学方程式是。
(6)符合下列条件的G的同分异构体有种,
写出其中任意一种的结构简式
A、能发生银镜反应和水解反应,且1mol该同分异构体能消耗2mol的NaOH
B、含有苯环,但不能与FeCl3显色。
C、不含甲基