(1)今有2H2+O2 =2H2O反应,构成碱性KOH燃料电池,则负极电极反应式为 ,正极电极反应式是 。
(2)若把KOH改为稀H2SO4作电解质,则负极电极反应式为 ;正极电极反应式为 。(1)和(2)的电解质不同,反应进行后,其溶液的pH个有什么变化? 。
(3)若把H2改为CH4,用KOH作电解质,则负极电极反应式为 ;正极电极反应式为 。
A~F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示: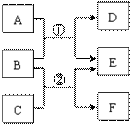
Ⅰ若A、C、E是氧化物,构成B、D的元素在同一主族,反应①②都是工业上的重要反应,通过反应②可以实现煤的气化,使煤变为清洁能源。
(1)写出反应①的化学方程式。
(2)用化学方程式表示E在冶金工业上的一种重要用途。
Ⅱ若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成。
(1)写出D的电子式。
(2)由A或C转化为E,每消耗1molB,转移电子的物质的量为mol。
(3)同温同压下,将V 1L A气体和V 2L E气体通入水中,
①若所得溶液的pH=7,则V1_____V2(填“>”或“<”或“=”)。
②若V1=2V2,反应后溶液中各离子浓度由大到小的顺序为。
已知:HCN的结构为H—C≡N;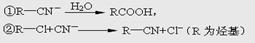
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 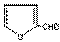 它是重要的化工原料,它在一定条件下可发生以下变化:
它是重要的化工原料,它在一定条件下可发生以下变化:
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应 方程式:
方程式:
。
⑶若E为环状化合物,则其结构简式。
⑷若E为高聚物,则其结构简式。
(5)玉米芯、甘蔗渣水解的产物 之一J,在酵母菌的作用下产生了一种温室气体Q和另一种有机物W。①写出Q的电子式: ;②写出实验室用W制取一种能使溴的四氯化碳溶液褪色的气体P的化学方程式: ;③将光亮的铜丝在酒精灯的外焰灼烧片刻后,再缓缓移入内焰,观察到铜丝又变得光洁无暇。请用最简洁的语言释之: 。
之一J,在酵母菌的作用下产生了一种温室气体Q和另一种有机物W。①写出Q的电子式: ;②写出实验室用W制取一种能使溴的四氯化碳溶液褪色的气体P的化学方程式: ;③将光亮的铜丝在酒精灯的外焰灼烧片刻后,再缓缓移入内焰,观察到铜丝又变得光洁无暇。请用最简洁的语言释之: 。
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):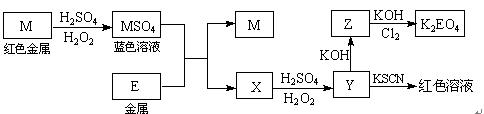
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷由E制备的E(C5H5)2 的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: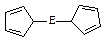 。核磁共振法
。核磁共振法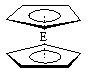 能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰(即有几种化学环境完全相同H原子),错误的结构有种峰。
能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰(即有几种化学环境完全相同H原子),错误的结构有种峰。
A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E原子序数的二倍。E阳离子与D阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A,E。
(2)D在周期表中位于第周期,第族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式。
(5)0.5mol BD与A2D完全反应转移的电子数为mol。
A、B、C、D、E、F、G、H、I、J 均为有机化合物,其转化关系如下图所示。已知B 和 C 均为有支链的有机化合物;C在反应③中只能生成一种有机产物;G能使溴的四氯化碳溶液褪色。回答问题: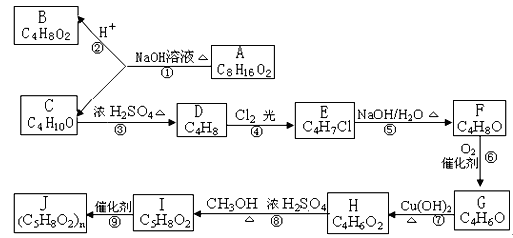
(1)G的结构简式:____________________。⑦的反应类型____________________。
(2)步骤⑤的化学方程式 ______________________________________________。
(3)步骤④中的“Cl2、光”能否改为“Cl2的四氯化碳溶液”?请说明原因:__________
(4)写出与H 具有相同官能团的任一种同分异构体的结构简式_____________________
(5)在一定条件下,酯与醇会发生酯交换,生成新的酯和醇。请尝试书写I与F发生的酯交换反应方程式:_____________________________________________________。
(6)一定条件下,G和H发生1:1聚合,聚合产物有多种。写出其中任一种聚合产物的结构简式:____________________________________________________________。