X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。
用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为__________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是______________。
(3)Y的最高价氧化物的电子式为__________。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________。
(4)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是_____________。
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。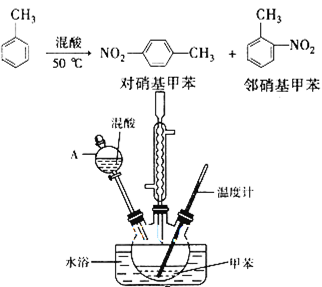
实验中可能用到的数据: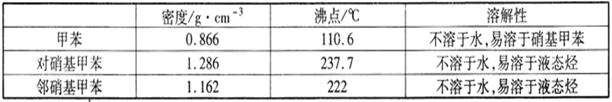
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是________。反应中需不断搅拌,目的是____________________
_____________________________。
(2)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:
其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
| A.冷凝管 | B.酒精灯 | C.温度计 | D.分液漏斗 e.蒸发皿 |
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
H2S在水中的电离方程式为。
(1)向H2S溶液中加入浓盐酸时,电离平衡向(填左、右、不)移动,c(H+)(填增大、减小、不变),c(S2-)(填增大、减小、不变)。
(2)向H2S溶液中加入NaOH固体,电离平衡向(填左、右、不)移动,c(H+)(填增大、减小、不变),c(S2-)(填增大、减小、不变)。
(3)若要使H2S溶液中c(HS-)增大,且使H2S的电离平衡逆向移动,可以加入。
(4)向H2S溶液中加水,c(HS-)(填增大、减小、不变),溶液pH(填增大、减小、不变)
互为同分异构体的有机物A、B、C的分子式均为C5H8O2,其中A为直链结构,加热时能与新制的氢氧化铜浊液反应,生成砖红色物质;A分子中核磁共振氢谱图中有三组峰,且峰面积之比为2:1:1。B为五元环酯。C的红外光谱表明其分子中存在甲基。A~I等有机物的转化关系如下:
已知:烯烃在一定条件下可与卤素单质发生a—H原子的取代反应。
(1)A、B的结构简式分别是:A,B。
(2)C为反式结构,其结构式为。
(3)写出下列反应的化学方程式;
D→C:。
G→H:。
(4)写出下列反应类型:
F→G,A→I中的①。
(5)写出F发生加聚反应生成的产物的结构简式。
(6)与A的官能团组成和个数均相同的同分异构体
还有个。
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/LKOH溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系正确的是
| A.c =" 1000b" / (22.4V) | B.p=" m+" Vc / 125 | C.n =" m" +17 Vc | D.5/3 <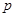 <17/ 9 <17/ 9 |
脱水偶联反应是一种新型的直接烷基化反应,例如:
(1)化合物Ⅰ的分子式为,1mol该物质完全燃烧最少需要消耗molO2。
(2)化合物Ⅱ可使溶液(限写一种)褪色;以化合物Ⅱ为原料可制备高分子化合物,其结构简式是;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1:1:1:2,Ⅳ的结构简式为。
(4)由CH3COOCH2CH3可合成化合物Ⅰ。化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ。Ⅴ的结构简式为,Ⅵ的结构简式为。
(5)一定条件下, 也可以发生类似反应①的反应,有机产物的结构简式为。
也可以发生类似反应①的反应,有机产物的结构简式为。