下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| A |
|
|
|
|
|||
| |
|
|
|
B |
C |
|
|
| D |
E |
|
|
|
|
F |
|
回答下列问题(对应物质书写相应化学式):
(1)元素B的元素符号为 ,它在元素周期表中的位置是 。
(2)D的简单离子的结构示意图为 ,它的最高价氧化物对应水化物中含有的化学键有 ,工业上冶炼D单质的化学方程式为 。
(3)用电子式表示EF2的形成过程 。
(4)由A2、C2构成碱性燃料电池,则该电池的负极反应方程式为 ,该电池工作过程中每通过2mol电子所需要的C2体积为 (标准状况)。
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g)△H= +131.3 kJ•mol-1
CO (g) +H2 (g)△H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有_______(填序号)。
| A.单位体积内每消耗1 mol CO的同时生成1molH2 |
| B.混合气体总物质的量保持不变 |
| C.生成H2O(g)的速率与消耗CO的速率相等 |
| D.H2O(g)、CO、H2的浓度相等 |
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在右图中继续画出t1时刻之后c(CO)随时间的变化。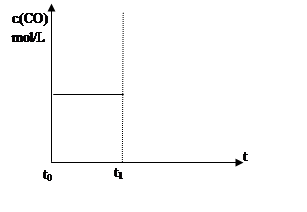
① 缩小容器体积(用实线表示)。
② 降低温度(用虚线表示)。
(5)某温度下,将6.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,
C (s) + H2O(g) CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
CO (g) +H2 (g),达到平衡时测得lgK= -1.0,求此温度下H2O(g)的
转化率(计算结果保留3位有效数字,要求写出计算过程)。
(6)己知:① C (s) + H2O(l) CO (g) +H2 (g)△H1
CO (g) +H2 (g)△H1
② 2CO(g) + O2(g) = 2CO2 (g)△H2
③ H2O (l)= H2 (g) +1/2 O2 (g)△H3
则2C (s) + O2 (g) = 2CO2 (g)的△H= _____________。
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________ (5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、______晶体
(7)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。 (8)用电子式表示B的硫化物的形成过程:_____________________________________
(8)用电子式表示B的硫化物的形成过程:_____________________________________
(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为__________;
(2)写出与H2O分子互为等电子体的微粒__________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)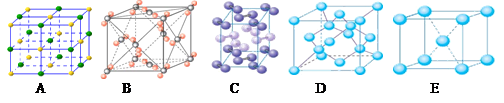
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:。
在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z。已知:①反应前的X与反应后生成的Z的物质的量之比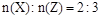 ;②单质Y的分子为正四面体构型。请填写下列空白。
;②单质Y的分子为正四面体构型。请填写下列空白。
(1)单质Y是___________,单质Z是___________(填分子式)。
(2)1个Y分子中共含___________个共价键。键角是。
(3)X分解为Y和Z的化学方程式为:。
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
a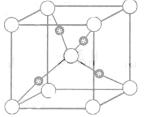
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ 键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。